
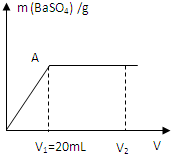
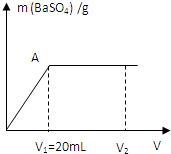
 室温下向20mL、c(OH-)=0.3mol/L的NaOH与Ba(OH)2溶液中滴加0.05mol/L的硫酸并不断地振荡,产生的沉淀随所加硫酸的体积(V)变化关系如图(混合体积的微小变化忽略不计):
室温下向20mL、c(OH-)=0.3mol/L的NaOH与Ba(OH)2溶液中滴加0.05mol/L的硫酸并不断地振荡,产生的沉淀随所加硫酸的体积(V)变化关系如图(混合体积的微小变化忽略不计):| 1 |
| 2 |
| n |
| c |
| 0.001mol |
| 0.02L |
| 1 |
| 2 |
| 0.003mol |
| 0.05mol/L |


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
 室温下向20mL、c(OH-)=0.3mol/L的NaOH与Ba(OH)2溶液中滴加0.05mol/L的硫酸并不断地振荡,产生的沉淀随所加硫酸的体积(V)变化关系如图(混合体积的微小变化忽略不计):
室温下向20mL、c(OH-)=0.3mol/L的NaOH与Ba(OH)2溶液中滴加0.05mol/L的硫酸并不断地振荡,产生的沉淀随所加硫酸的体积(V)变化关系如图(混合体积的微小变化忽略不计):查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市高二(上)期中化学试卷卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com