
| A、10mL | B、5mL |
| C、大于5mL | D、小于5mL |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
| A、NO2通入FeSO4溶液中 |
| B、CO2通入CaCl2溶液中 |
| C、NH3通入AlCl3溶液中 |
| D、SO2通入酸性KMnO4溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA |
| B、100 mL 0.1 mol?L-1 Na2CO3溶液中,离子总数是0.03NA |
| C、标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023 |
| D、6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 预期现象与结论 |
| 现象: 结论: | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制取D时,使用水浴加热 |
| B、A能与溴水和酸性KMnO4溶液发生氧化还原反应,而使它们褪色 |
| C、D的同分异构体中含有羧基的有3种 |
| D、B和C的熔点和沸点都比C2H6、C2H4的沸点和熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
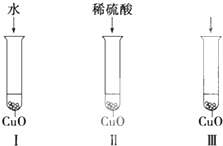 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol?L-1盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol?L-1硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol?L-1硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com