
【题目】化学与生活、环境等各方面紧密相关,下列相关说法正确的是
A. 机动车单双号限行是从根本上解决汽车尾气污染问题的一种途径
B. 油锅着火应立即用水浇灭
C. 石灰乳刷墙后逐渐变硬的原因是石灰乳在空气中逐渐失水干燥
D. 我们已将PM2.5纳入空气质量检测报告
科目:高中化学 来源: 题型:
【题目】J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
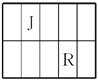
(1)M的离子结构示意图为________;元素T在周期表中位于第________族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为_____________________。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为________________________________________________________________________。
(4)L的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如图所示的转化,其中X是单质,Y在常温下是气态氢化物,Z、W是氧化物R是W和水反应的产物。下列判断错误的是( )
![]()
A. X不可能是金属单质 B. Y生成Z属于置换反应
C. Z生成W发生了电子转移 D. Y和R可能会发生反应生成一种盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下方法可用于工业冶炼金属的是
A.电解熔融AlCl3获取金属铝B.电解MgCl2溶液获取金属镁
C.用CO还原铁矿石来获取金属铁D.电解饱和食盐水来获取金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:H2(g)+ ![]() O2(g)=H2O(l);△H=﹣285.8kJ/molCO(g)+
O2(g)=H2O(l);△H=﹣285.8kJ/molCO(g)+ ![]() O2(g)=CO2(g);△H=﹣283.0kJ/molC8H18(l)+
O2(g)=CO2(g);△H=﹣283.0kJ/molC8H18(l)+ ![]() O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣890.3kJ/mol 相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
O2(g)=8CO2(g)+9H2O(l);△H=﹣5518kJ/molCH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=﹣890.3kJ/mol 相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是( )
A.H2(g)
B.CO(g)
C.C8H18(l)
D.CH4(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】席夫碱类化合物G在催化、药物、新材料等方面有广泛应用。合成G的一种路线如下:
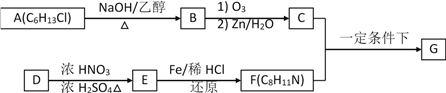
已知以下信息:
①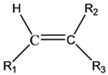
![]()
![]()
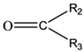
②1 mol B经上述反应可生成2 mol C,且C不能发生银镜反应。
③D属于单取代芳烃,其相对分子质量为106。
④核磁共振氢谱显示F苯环上有两种化学环境的氢
⑤![]()
回答下列问题:
(1)由A生成B的化学方程式为____________,反应类型为____________。
(2)D的化学名称是____________,由D生成E的化学方程式为:____________。
(3)G的结构简式为____________。
(4)由苯和化合物C经如下步骤可合成N-异丙基苯胺。
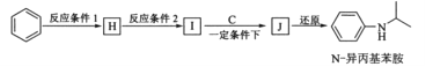
反应条件1所选择的试剂为____________;反应条件2所选择的试剂为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]() (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为_____kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a____________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
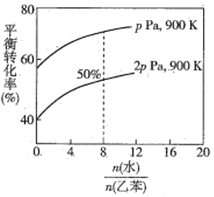
①加入水蒸气稀释剂能提高乙苯转化率的原因是________________________________。
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为________ (答两点)。
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=_______。
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是________ (填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛: ![]() (g) + 2O2→
(g) + 2O2→![]() + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中的相关描叙中,不正确的是
A. 常温下,Ksp[R(OH)3]=1.0×10-38,在c(R3+)=0.010mol/L的溶液中,当pH≥2.0时R3+开始沉淀
B. 常温下,将0.1mol/LCH3COOH溶液加水稀释,当溶液的pH从3.0开到5.0时,溶液中c(CH3COO-)/(CH3COOH)的值增大到原米的100倍
C. 0.02mol/L的NaOH溶液与0.02mol/L的NaHC2O4溶液等体积混合后,则有: c(Na+)=2[c(C2O42-)+c(HC204-)+c(H2C2O4)]
D. 常温下,将1.0mol/L硫酸与amol/L氨水等体积混合至溶液呈中性,则NH4+的水解常数(Kh)计算式为=(a-1)×10-7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com