
由铝土矿(主要成分是Al2O3)炼制铝的工艺流程示意图如下:
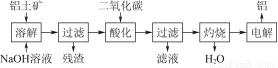
(1)电解生成的铝在熔融液的 (填“上层”或“下层”),电解时不断消耗的电极是 (填“阴极”或“阳极”)。
(2)写出通入过量二氧化碳酸化时反应的离子方程式
。
(3)电解制备铝时,需加入冰晶石(Na3AlF6),其作用是 ,工业上可以用氟化氢气体、氢氧化铝和纯碱在高温条件下发生反应来制取冰晶石,写出该反应的化学方程式 。
(4)上述工艺所得铝中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池的阴极材料是 (填化学式),阳极的电极反应式为 。
(5)对金属制品进行抗腐蚀处理,可延长其使用寿命。
①控制一定条件进行电解(见图),此时铝表面可形成耐酸的致密氧化膜,其电极反应式为 ;
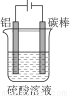
②钢材镀铝后,能防止钢材腐蚀,其原因是 。
(1)下层 阳极
(2)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(3)助熔剂(或降低熔化温度) 2Al(OH)3+12HF+3Na2CO3 2Na3AlF6+3CO2+9H2O
2Na3AlF6+3CO2+9H2O
(4)Al Al-3e-=Al3+
(5)①2Al-6e-+3H2O=Al2O3+6H+
②致密的氧化铝膜起着保护内部金属的作用,若镀层破损后,与电解质溶液接触时形成原电池,铝作负极防止钢材被腐蚀
【解析】(1)电解熔融的氧化铝冶炼铝,阳极生成O2,与石墨电极反应生成CO。(3)氧化铝的熔点很高,是常用的耐高温材料,故冶炼时加入冰晶石降低其熔点。(4)迁移电解法精炼铜的原理,电解时铝在阴极析出,故阴极材料为纯铝。(5)根据题中信息,铝表面生成的应为Al2O3,故阳极电极反应为铝失去电子,生成的Al3+与H2O作用形成Al2O3。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014高考化学二轮复习限时集训 专题7化学反应速率和化学平衡练习卷A(解析版) 题型:选择题
纳米钴(Co)常用于CO加氢反应的催化剂,500 K时有催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
CH4(g)+H2O(g) ΔH<0。下列有关说法正确的是( )
A.纳米技术的应用,提高了催化剂的催化性能
B.缩小容器体积,平衡向正反应方向移动,CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分离出H2O(g)能加快正反应速率
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题4离子反应练习卷(解析版) 题型:选择题
下列有关离子反应或离子方程式的叙述中,正确的是( )
A.能使pH试纸显深红色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
B.惰性电极电解氯化铝溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.镁与极稀硝酸反应生成硝酸铵的离子方程式为4Mg+6H++NO3—=4Mg2++NH4++3H2O
D.将10 mL 0.1 mol·L-1 KAl(SO4)2溶液和10 mL 0.2 mol·L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1∶2
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题17有机化学基础练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.纤维素属于髙分子化合物,与淀粉互为同分异构体,水解后均生成葡萄糖
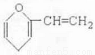
B.某有机物结构如图所示,该有机物属于芳香族化合物的同分异构体有5种,其中遇FeCl3溶液能显色的有3种
C.5个碳原子的有机物,每个分子中最多可形成4个碳碳单键
D.2,3?二甲基丁烷的H—NMR上有5个峰
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题16物质结构与性质练习卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.金刚石、碳化硅、晶体硅的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,每个CaO晶胞中含有4个Ca2+和4个O2-
C.设NaCl的摩尔质量为M g·mol-1,NaCl的密度为ρ g·cm-3,阿伏加德罗常数为NA mol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为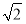 ·
·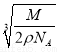 cm
cm
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的组成式为XY3
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷B(解析版) 题型:实验题
某化学小组用下列装置对铁及其化合物的性质进行探究,回答有关问题:
(1)该小组同学想制得氢氧化亚铁并保存较长时间,按如图(a)所示装置对其进行操作。
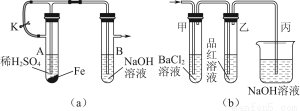
①某同学的操作是:先夹紧止水夹K,再使A管开始反应,实验中在B管中观察到的现象是
。
②为达到实验目的,正确的操作是 。
B管中发生反应的离子方程式是 。
(2)当上述装置的实验结束后,取A管内反应所得的溶液,隔绝空气小心蒸干后得到FeSO4,再高温煅烧(有关装置和操作均已略去),最后留下红棕色固体,将分解时产生的气体按图(b)所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内品红溶液红色褪去,回答:
①用方程式表示试管甲产生白色沉淀的原因
。
②为验证红棕色固体成分,可进行如下操作
。
③图(b)中丙装置的作用是 。
④根据实验现象写出A管内溶液蒸干后,在高温煅烧分解时所发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题14综合实验与探究练习卷A(解析版) 题型:实验题
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由 (用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有 _;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下:
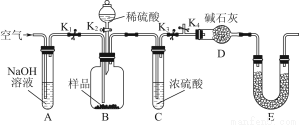
①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 _ 、洗涤、干燥;
②装置E中药品的名称是 __作用为 __;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是 ;
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是 _,关闭的是 _。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为 _
若假设三成立,则Cu(OH)2的质量分数为 _;若不进行步骤c,则会使测得结果 (填“偏高”“无影响”“偏低”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题13化学实验基础练习卷(解析版) 题型:选择题
下列实验操作正确且能达到预期目的的是( )
实验目的操作
A检验淀粉水解产物有还原性淀粉溶液和稀H2SO4混合加热,冷却后,再加新制的Cu(OH)2悬浊液加热至沸腾
B证明SO2具有漂白性将SO2通入溴水中
C为了提取溴水中的溴加入植物油进行萃取
D浓、稀HNO3分别与Cu反应比较浓、稀HNO3的氧化性强弱
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题10非金属元素单质及化合物练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片
B.Si、P、S、Cl相应的最高价氧化物对应的水化物的酸性依次增强
C.工业上通常用电解钠、铁、铜对应的氯化物制得这3种金属单质
D.金属铝、铁、铜都有一定的抗腐蚀性能,其抗腐蚀的原因都是表面形成氧化物薄膜,阻止反应的进一步进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com