
分析 若将此温度(t℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合,此时NaOH溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,稀硫酸溶液中c(H+)=0.1mol/L,
(1)溶液呈中性,说明酸和碱恰好完全反应,根据溶液的酸碱性及电荷守恒确定离子浓度大小;
(2)若所得混合液的pH=2,根据c(H+)=$\frac{c(酸)V(酸)-c(碱)V(碱)}{V(酸)+V(碱)}$计算酸碱的体积比,根据溶液的酸碱性及物料守恒判断离子浓度大小.
解答 解:pH=11的NaOH溶液中氢氧根离子浓度为:c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,稀硫酸溶液中氢离子浓度为:c(H+)=0.1mol/L,则:
(1)若所得混合液为中性,则有:0.01a=0.1b,
解得:a:b=10:1;
混合溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得:c(Na+)>c(SO42- ),该溶液为盐溶液,硫酸根离子浓度大于氢离子浓度,所以离子浓度大小顺序是:c(Na+)>c(SO42-)>c(H+)=c(OH-),
故答案为:10:1; c(Na+)>c(SO42- )>c(H+)=c(OH-);
(2)若所得混合液的pH=2,则有:$\frac{0.1b-0.01a}{a+b}$=0.01,
解得:a:b=9:2;
溶液呈酸性,则:c(H+)>c(OH-),
溶液中氢离子浓度为0.01mol/L,硫酸根离子浓度为:$\frac{0.05×2}{2+9}$mol/L=0.009mol/L,
所以氢离子浓度大于硫酸根离子浓度,根据物料守恒知,c(SO42-)>(Na+),氢氧根离子浓度最小,
所以离子浓度大小顺序为:c(H+)>c(SO42- )>c(Na+)>c(OH-),
故答案为:9:2;c(H+)>c(SO42- )>c(Na+)>c(OH-).
点评 本题考查酸碱混合的定性判断、离子浓度大小比较,题目难度中等,注意掌握根据溶液的酸碱性及电荷守恒判断离子浓度大小的方法,注意题中水的离子积常数是10-13而不是10-14,为易错点,试题培养了学生的化学计算能力.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:多选题
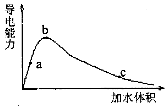 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:c<b<a | |
| B. | 溶液的PH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的PH试纸上,测得PH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氯蔗糖(C12H19Cl3O8)属于天然的糖类甜味剂 | |
| B. | 未成熟的青苹果肉遇碘酒变蓝色,成熟苹果的汁能发生银镜反应 | |
| C. | 利用盐析的方法可以用来分离、提纯蛋白质 | |
| D. | 酚醛树脂、合成橡胶、有机玻璃都属于有机高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=7的溶液 | |
| B. | 非电解质溶于水得到的溶液 | |
| C. | 由强酸和强碱等物质的量反应得到的物质 | |
| D. | c (H+)=c (OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应掉的三种金属的质量相等 | B. | 反应后三种金属质量相等 | ||
| C. | 所用盐酸均过量 | D. | 三种金属可以都有剩余 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
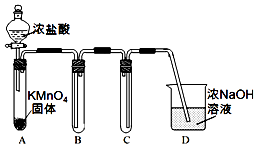 某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.| 烧杯编号 | 1 | 2 | 3 | 4 |
| 氯酸钾饱和溶液 | 1mL | V1mL | V2mL | V3mL |
| 氯化钾固体 | 1g | 1g | 1g | 1g |
| 水 | 8mL | V4mL | 3mL | 0mL |
| 硫酸(6mol/L) | V5mL | 2mL | V6mL | 8mL |
| 现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
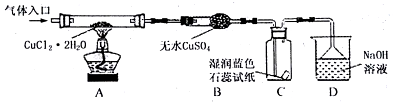
| 资料一 | CuCl2•2H2O | 在HCl气流中加热至140℃ | 产生CuCl2 | CuCl2在受热大于300℃时 | 生成CuCl和Cl2 |
| 资料二 | CuCl2•2H2O | 直接加热 | 产生Cu2(OH)2Cl2 | Cu2(OH)2Cl2在受热到200℃时 | 产生CuO |
| 步骤 | 操作描述 |
| ① | 检验装置的气密性后加药品 |
| ② | 在“气体入口”处通干燥HCl |
| ③ | 点燃酒精灯,加热 |
| ④ | 熄灭酒精灯,冷却 |
| ⑤ | 停止通入HCl,然后通入N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com