
| c(Ca2+) |
| c(Mg2+) |
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
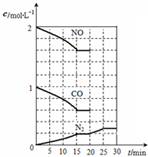 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1低温可自发进行 |
| B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| C、室温时,0.1mol/L某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 |
| D、将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明铝比镁活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率为0 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeS、Al(OH)3和S |
| B、Fe(OH)3和Al(OH)3 |
| C、Fe2S3和 Al(OH)3 |
| D、Al2S3、FeS和S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 向3-4mL 1mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全. |
| 实验现象 | 产生白色沉淀 |
| 离子方程式 | (1) |
| 小组讨论交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
| 假设出现的实验现象,说明理由 | 假设Ⅰ:无现象; 理由:反应没有限度,Ca2+沉淀完全 假设Ⅱ:(2) |
| 证明你的假设 | 现象:产生大量的白色沉淀 |
| 离子方程式 | (4) |
| 实验结论 | (5) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
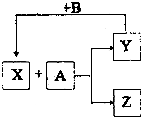 以下各物质均为中学阶段常见的物质,其中B 是单质,它们的相互转化关系如图
以下各物质均为中学阶段常见的物质,其中B 是单质,它们的相互转化关系如图查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com