
【题目】某蓄电池放电、充电的反应式为:Fe+Ni2O3+3H2O ![]() Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( ) ①放电时,Fe为正极,Ni2O3为负极;
Fe(OH)2+2Ni(OH)2 , 下列推断中正确的是( ) ①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e﹣═Fe+2OH﹣;
③充电时,Ni(OH)2为阳极;④蓄电池的电极必须浸在某碱性溶液中.
A.①②③
B.①②④
C.①③④
D.②③④
【答案】D
【解析】解:①由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故①错误;
②充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH﹣﹣2e﹣=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e﹣=Fe+2OH﹣,故②正确;
③充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O,Ni(OH)2做阳极,故③正确.
④根据总反应Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,碱性电解质中最终生成Fe(OH)2,所以电解质溶液是碱,故④正确;
故选D.
根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH﹣﹣2e﹣=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e﹣=Fe+2OH﹣,阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH﹣﹣2e﹣=Ni2O3+3H2O.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中正确的是( )
4NO(g)+6H2O(g),下列叙述中正确的是( )
A. 达到化学平衡时,5v正(O2)=4v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 未达到化学平衡时,正反应速率一定不等于逆反应速率
D. 达到化学平衡时,3v正(NH3)=2v正(H2O)不成立
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法正确的是
A.C60与金刚石一样属于原子晶体
B.由非金属元素组成的化合物不一定是共价化合物
C.分子晶体中必含化学键
D.干冰升华破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.被誉为改变未来世界的十大新科技之一的燃料电池。 右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.

试回答下列问题:
(1)燃料电池的优点是________;电解质溶液中的OH-移向______极(填“负”或“正”).
(2)写出氢氧燃料电池工作时正极反应式:_______________________。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________.
(4)利用该装置可以处理氮的氧化物和NH3 尾气,总反应为:6NO2 +8NH3=7N2+12H2O,负极反应式为__________。
II.将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为41g,试计算:
(1)产生氢气的体积(标准状况)为________________;
(2)通过导线的电子数为__________(用NA表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作正确的是
选项 | 实验 | 操作 |
A | 配制Fe(NO3)2溶液 | 将Fe(NO3)2溶于稀硝酸中,再加水稀释到所需浓度 |
B | 证明苏打溶液中存在水解平衡 | 向含有酚酞的苏打溶液中加入少量BaCl2固体,观察溶液颜色 |
C | 检验加碘食盐中含有碘元素 | 取少量加碘食盐配成溶液,然后滴加淀粉溶液,观察溶液颜色 |
D | 确定H2SO3和H2CO3酸性强弱 | 将SO2和CO2分别通入水中达到饱和,用pH计立即测定溶液pH,比较pH大小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是几种常见的化学电源示意图,有关说法不正确的是( ) 
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.铅蓄电池工作过程中,每通过 2 mol 电子,负极质量减轻 207 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃下,稀释HA、HB 两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,a点时,HB溶液中B的物质的量分数 ,下列说法正确的是
,下列说法正确的是

A. HA、HB都是弱酸
B. 加水稀释过程中,δ(B )减小
C. NaB溶液中,c(Na+)=c(B-)+c(OH-)
D. 曲线上b、c两点c(B-)/[c(HB)·c(OH-)]相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机化合物G是一种生物降解塑料,其合成路线如下:

己知:①![]() (R1、R2表示烃基)
(R1、R2表示烃基)
②E不能与银氨溶液发生反应,但能与Na反应。
③
(1)A的化学名称为________
(2)生成B的反应类型为________,生成C的反应类型为________
(3)由B生成C的化学方程式为________
(4)G的结构简式为________
(5)E的同分异构体很多,能同时满足下列条件的链状化合物共有________种(不含立体异构),其中核磁共振氢谱有4组峰值,且峰面积比为2:2:1:1的结构简式为_______。
①含有三种官能团;②能与新制的Cu(OH)2悬独液反应;③氧原子不与碳碳双键相连④与Na反应可放出氢气。
(6)写出用苯和CH3COCl为原料制备化合物![]() 的合成路线(无机试剂任选):_____。
的合成路线(无机试剂任选):_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO2溶液在不同温度下均可被过量KlO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020 molL﹣1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )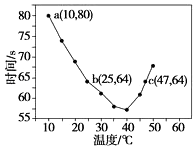
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中a点对应的NaHSO3反应速率为5.0×10﹣5 molL﹣1s﹣1
C.图中b、c两点对应的NaHSO3反应速率相等
D.40℃之后,淀粉不宜用作该实验的指示剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com