
【题目】已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大。X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态。请回答下列问题:
(1)R基态原子的外围电子排布式为____,其基态原子有__种能量不同的电子。
(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)____。
(3)与XYZ-互为等电子体微粒的化学式为______(写出一种即可),XYZ-的中心原子的杂化方式为_____。
(4)R2+与NH3形成的配离子中,提供孤对电子的原子是__。
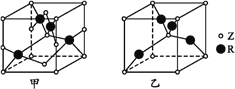
(5)已知Z、R能形成两种化合物,其晶胞如图所示,甲的化学式为__,乙的化学式为__;高温时,甲易转化为乙的原因为_____________。
(6)若甲晶体中一个晶胞的边长为a pm,则甲晶体的密度为______g·cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。
【答案】 3d104s1 7 N>O>C CO2或N2O或SCN- sp N CuO Cu2O Cu2O中的Cu的3d能级是全充满状态,而原子处于全充满、半充满、全空是稳定结构 ![]()
【解析】核外电子有6种不同的运动状态,则核外有6个电子,即X是碳(C);Z原子的L电子层上有2对成对电子,是2p4,则为氧(O);根据原子序数递增知Y是氮(N);R+原子核外有3层电子且各层均处于全满状态,分别有2、8、18个电子,即R是铜(Cu)。
(1)Cu的基态原子的外围电子排布式为3d104s1,核外电子分布在1s、2s、2p、3s、3p、3d、4s,共7个能级,因此其基态原子有7种能量不同的电子,
故答案为:3d104s1;7;
(2)同周期第一电离能由左向右呈增大的趋势,ⅡA元素原子的s能级是全充满状态、ⅤA元素原子的p能级是半充满状态,它们第一电离能比相邻元素大,即第一电离能:N>O>C,
故答案为:N>O>C;
(3)与CNO互为等电子体微粒的化学式有CO2、N2O、SCN等,互为等电子体的物质结构相似,CO2的结构是直线型,C原子采取sp杂化,因此CNO的中心原子的杂化方式为sp,
故答案为:CO2或N2O或SCN;sp;
(4)N原子有孤对电子,Cu2+有空轨道,即N提供孤对电子;
故答案为:N;
(5)根据均摊法知甲晶胞中含Cu原子4个,O原子:8×![]() +4×
+4×![]() +2×
+2×![]() +1=4,化学式为CuO;乙含Cu原子4个,O原子:8×
+1=4,化学式为CuO;乙含Cu原子4个,O原子:8×![]() +1=2,化学式为Cu2O,CuO易转变为Cu2O,是因为Cu2O中的Cu的3d能级是全充满状态,而原子处于全充满、半充满、全空是稳定结构。
+1=2,化学式为Cu2O,CuO易转变为Cu2O,是因为Cu2O中的Cu的3d能级是全充满状态,而原子处于全充满、半充满、全空是稳定结构。
故答案为:CuO;Cu2O;Cu2O中的Cu的3d能级是全充满状态,而原子处于全充满、半充满、全空是稳定结构。
(6)甲中1个晶胞含4个Cu原子,4个O原子,m=![]() ,晶胞体积为(a×1010)3m3,则密度=
,晶胞体积为(a×1010)3m3,则密度= 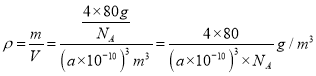 。
。
故答案为: 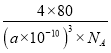


科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系错误的是( )
A.0.1 mol?L﹣1 CH3COOH溶液中:c(CH3COO﹣)+c(OH﹣)=c(H+)
B.0.1 mol?L﹣1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO ![]() )+c(OH﹣)
)+c(OH﹣)
C.25℃时,有等浓度的①NH4HSO4溶液、②NH4HCO3溶液中c(NH ![]() ):①>②
):①>②
D.含等物质的量的NaX和弱酸(HX)混合溶液中一定存在:c(Na+)>c(X﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳化学”是绿色化学的重要组成部分。
(1)由CO2制备甲醇的过程发生的主要反应如下:
反应I: CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H 1<0;
CH3OH(g)+ H2O(g) △H 1<0;
向2 L恒容密闭容器中充入3molH2和1.5molCO2,在一定条件下该反应l0min时达到平衡状态,二氧化碳的转化率a(CO2)=60%,则v(H2) =_________________________。(填字母)。
若要同时提高反应速率和甲醇的产量,以下措施一定可行的是
a.升高温度 b.缩小容器体积 c.分离出甲醇 d.增加CO2的浓度
(2)已知: CO2(g)+ 2H2(g)![]() C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
C(s)+ 2H2O(g) △H =-90.0kJ/mol ;H2O(1)=H2O(g) △H =+44.0kJ/mol; C(s)的燃烧热为394.0kJ/mol。则H2的燃烧热为_________kJ/mol。
(3)在某条件下,将4molH2和1molCO2,置于2L密闭容器中发生反应:
反应II :CO2(g)+4H(g) ![]() CH4(g)+2H2O(g) △H2
CH4(g)+2H2O(g) △H2
反应Ⅲ: CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
CO2转化率、CH4和CO 选择性随温度变化情况分别如图所示(选择性: 转化的CO2中生成CH4或CO 的百分比)。
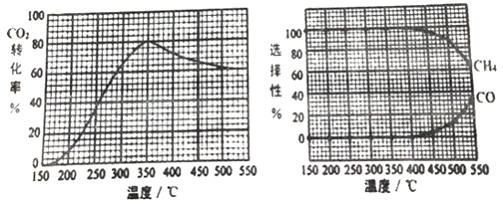
①反应II的△H2________(填“>”、“<“或“=")0,理由是_________________________。
②350℃时,反应II 的平衡常数K=_______。为减少CO 在产物中的比率,可采取______的措施有______(例举一例回答)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.AlCl3溶液中通入过量的氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B.向NH4 HCO3溶液中加过量NaOH 溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.将Cu片加入稀硝酸中:3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
D.向Na2S2O3溶液中加入稀硫酸:2S2O32—+2H+=SO42—+3S↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应 MnO2+4HCl(浓)== MnCl2+Cl2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________.
②氧化剂是________,氧化产物是________.
③在标准状况下有44、8L Cl2生成时,被氧化的物质是________mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,含碳微粒(H2C2O4、HC2O4-、C2O42-)存在于0.1mol/L草酸溶液与等浓度NaOH溶液反应后的溶液中,它们的物质的量分数ω(某微粒物质的量浓度与三种微粒物质的量浓度和比值)与溶液pH的关系如图所示,下列有关说法错误的是
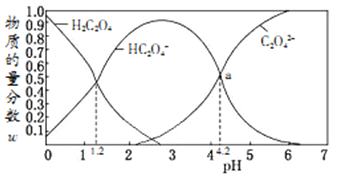
A. 向pH=1.2的溶液中加NaOH溶液将pH增大至4.2的过程中水的电离度一直增大
B. pH=4.2时,溶液中c(Na+)>c(HC2O4-)+c(C2O42-)
C. 若草酸的第二级电离平衡常数为K2,则lgK2=-4.2
D. 将0.1mol/L相同物质的量浓度NaHC2O4和Na2C2O4的两份溶液等体积混合,可配得上图a点所示混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能够大量共存的是( )
A.Na+、Cl﹣、NO3﹣
B.Ag+、Cl﹣、NO3﹣
C.NH4+、OH﹣、SO42﹣
D.Na+、Fe2+、OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,CaSO4的沉淀溶解平衡曲线如图,Ksp(CaSO4)=9×10﹣6 . 下列判断错误的是( ) 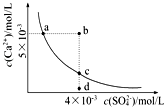
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO ![]() )一定等于3×10﹣3 mol?L﹣1
)一定等于3×10﹣3 mol?L﹣1
D.向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com