


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、NaI和NaIO3在一定条件下能反应生成I2 |
| B、I2在反应①中是还原产物,在反应②中是氧化产物 |
| C、两个反应中生成等量的I2时转移电子数相等 |
| D、氧化性:Mn02>SO42->I03->I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe(NO3)3加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| B、硫酸镁溶液与氢氧化钡溶液混合:SO42-+Ba2+═BaSO4↓ |
| C、等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| D、Cu溶于足量稀硝酸:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能、地热能、核能等均属于新能源 |
| B、“低碳”是指采用含碳量低的烃类化合物作燃料 |
C、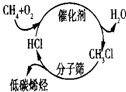 甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想 |
| D、减少化石能源的使用能减少CO2的排放量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
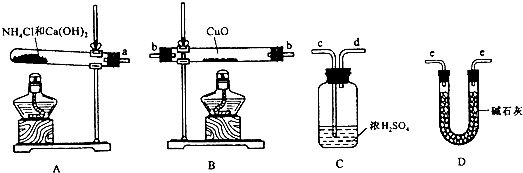
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.0g/mol |
| B、5.0g/mol |
| C、10.0g/mol |
| D、4.0g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | (Ⅰ) | (Ⅱ) |
| A | 少量H2SO4(aq)滴入Ba(OH)2(aq)中 | 少量NaHSO4(aq)滴入Ba(OH)2(aq)中 |
| B | 少量NaOH(aq)滴入Al2(SO4)3(aq)中 | 少量Al2(SO4)3滴入氨水中 |
| C | 少量Ca(HCO3)2(aq)滴入Ca(OH)2(aq)中 | 少量Ca(OH)2(aq)滴入Ca(HCO3)2(aq)中 |
| D | 少量盐酸滴入Na2CO3(aq)溶液中 | 少量Na2CO3(aq)滴入盐酸中 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
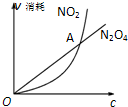 已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )
已知可逆反应:2NO2(g)N2O4(g)中,NO2、N2O4的消耗速率与其浓度存在如下关系:v(NO2)=k1?c2(NO2),v(N2O4)=k2?c(N2O4)(其中k1、k2是只与温度有关的常数),一定温度下根据上述关系式建立如图关系.下列说法正确的是( )| A、图中A点对应的状态表示该反应达到化学平衡 |
| B、若某温度时k1=k2,则该温度下反应的平衡常数K=0.5 |
| C、在1L密闭容器中充入1 mol NO2,平衡时:c(NO2)+c(N2O4)=1 mol?L-1 |
| D、在1L密闭容器中充入1 mol NO2,当c(NO2)=c(N2O4)时,NO2的转化率是33.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com