
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑ | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | CaO+H2O═Ca(OH)2 |
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 结论 |
| A | 无色试液中加入AgNO3溶液产生白色沉淀 | 试液中含有Cl- |
| B | 无色溶液加酚酞变红色 | 溶液的溶质是碱 |
| C | 碱性无色溶液中加入Na2CO3溶液产生白色沉淀 | 溶液中有Ca(OH)2 |
| D | 某气体能使湿润的红色石蕊试纸变蓝色 | 该气体中有NH3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若增大压强,则混合气体的平均分子量减小 | |
| B. | 将容器体积变为0.5 L,Z的平衡浓度变为原来的2倍 | |
| C. | 以X浓度变化表示的反应速率为0.01 mol/(L•s) | |
| D. | 保持体积不变,向其中充入1 mol He气体,平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
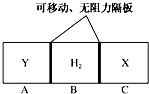 如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )
如图所示,在一个容积固定的恒温容器中,有两个可左右滑动的密封隔板,在C、A处充入均为10g的X、Y两种气体,且测得二者的密度相等.当隔板停止滑动时,下列说法一定正确的是( )| A. | X、Y均为气体单质 | |
| B. | X、Y的相对分子质量相等 | |
| C. | n(H2)<n(X)=n(Y) | |
| D. | 隔板停止滑动时,A、B、C三部分体积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2→O2的变化过程中,必须要加入合适的氧化剂才能实现 | |
| B. | Al2O3+3C+N2═2AlN+3CO中,Al2O3是氧化剂 | |
| C. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中MnO2是还原剂 | |
| D. | 有金属单质参加的反应中,金属单质一定作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com