
|
下列七种说法:① Na2O2不是氧化物,也不是碱性氧化物;②H2O2是酸,Na2O2是盐;③钾及其化合物中常含有少量的钠或其化合物,因此观察钾火焰的颜色时常透过钴玻璃以滤去黄光;④同Na2O2一样,PbO2、CO2也是过氧化物;⑤NaOH溶液不能用带玻璃塞的试剂瓶保存;⑥因玻璃中含有钠元素,所以在玻璃管口点燃H2时,常见到火焰呈黄色.其中正确的组合是 | |
| [ ] | |
A. |
①②③④ |
B. |
③④⑤⑥ |
C. |
②③⑤⑥ |
D. |
①③④⑤ |
|
讲析:氧化物是指由两种元素组成,且其中一种元素是氧元素的化合物,所以 Na2O2是氧化物.而碱性氧化物是指与酸反应生成盐和水的氧化物,Na2O2与酸反应除生成盐和水之外,还生成了氧气,即2Na2O2+4HCl点评:解答元素化合物有关题目,可以从概念入手,逐个分析,利用排除法,得出正确答案. sss |


科目:高中化学 来源: 题型:阅读理解
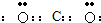
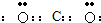
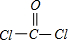
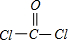
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期中考试化学试卷(解析版) 题型:选择题
1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。下表给出的是第三周期的七种元素和第四周期的钾元素的电负性的值。下列说法不正确的是( )
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
? |
2.1 |
2.3 |
3.0 |
0.8 |
A 钙元素的电负性的取值范围在0.8与1.2之间
B. 硫化钠的电子式为
C 硅元素的电负性的取值范围 在1.5与2.1之间
D Al与S形成的化学键可能为共价键
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高三“一诊”模拟考试(理综)化学部分 题型:填空题
A、Z、R、D、E、F、G是七种原子序数依次增大且不大于20的元素,其中有两种非金属元素位于同一土族。己知A、Z、D均能与R形成原子(或离子)个数不同的儿种常见化合物。请回答下列有关问题。
(1)若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式) ,导致这种差异存在的原因是 在相同温度下,相等物质的量浓度的X、Y各自的溶液中,由水电离出的c(H+)的相对大小关系为 。
(2)A与Z、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol.则其燃烧的热化学方程式 。
(3)R与D、F间;R与F、G间均可形成多种化合物,其中有两种是目前广泛使用的具有消毒杀菌能力的化合物。则相同物质的量浓度的这两种物质的溶液,消毒杀菌能力较强的物质的化学式为 ,另一种物质的溶液中,各离子浓度由大到小的顺序为 。
(4)上述七种元素间能形成多种常见二元化合物,其中Z与G形成的一种化合物存在两类化学键的物质溶于HC1溶液的化学反应方程式为 ,ZR2的电子式是 ,该分子的空间构型为 化合物ZRF2的结构式为____
(5)R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,则1molR4中共用电子对数为____NA,列有关R4的说法中正确的是
①R4与R3、R2互为同位素
②R4不能与A、Z、D的单质反应
③R4中各原予最外层均为8电子结构
④R4是1种新型化合物
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2011年四川省成都市青羊区石室中学高考化学一模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com