
【题目】下表为元素周期表中的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
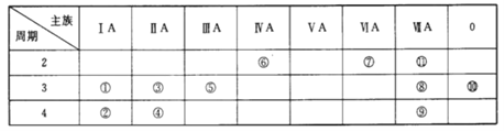
I. (1)化学性质最不活泼的元素是_____(填元素符号,下同),非金属性最强的元素是_____。金属性最强的单质与水反应的离子方程式是________。
(2)①③⑤三种元素的最高价氧化物对应的水化物中,碱性最强的化合物的化学式是____。
(3)①②③三种元素的原子半径由大到小的顺序是____>____>_____。
(4)某元素的最高价氧化物对应的水化物既能与酸反应生成盐和水又能和碱反应生成盐和水,该元素为_____。在这两种盐中该元素的化合价为_____,该元素的最高价氧化物和盐酸反应的离子方程式为_______。向该元素和⑧号元素形成的化合物的溶液中,缓慢滴加氢氧化钠溶液至过量,产生的实验现象是_______,有关反应的化学方程式为_______。
II.下列物质:①N2②CO2③NH3④Na2O⑤Na2O2⑥ NaOH ⑦CaBr2⑧H2O2 ⑨NH4Cl⑩Ar
(1)既含有极性键又含有非极性键的是_______;(填序号,下同)
(2)含有非极性键的离子化合物是___________
(3)不含化学键的是___________
【答案】Ar F 2K+2H2O=2K++2OH-+H2↑ NaOH K Na Mg Al +3 Al2O3+6H+=2Al3++3H2O 先产生白色沉淀,后沉淀逐渐溶解消失 AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O ⑧ ⑤ ⑩
【解析】
首先将表格中11种元素具体化。依编号顺序,这11种元素依次是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar、F。然后将问题的元素编号一一具体化到某元素,利用元素周期律相关知识进行分析即可。
(1)寻找最活泼的非金属,搜索目标是向上向右,寻找最活泼的金属元素,搜索目标是向左向下;
(2)最高价氧化物水化物的碱性最强,其元素的金属性也最强;
(3)利用同主族和同周期原子半径的变化规律进行比较;
(4)涉及氢氧化铝沉淀的生成和溶解;
(5)分析每一种物质的化学键种类,再挑出所问的3个问题指向的物质编号。
I. (1)化学性质最不活泼的元素是稀有气体元素Ar,非金属性最强的元素是F。金属性最强的单质是K,其与水反应的离子方程式是2K+2H2O=2K++2OH-+H2↑;
(2)①③⑤三种元素分别为Na、Mg、Al,其最高价氧化物对应的水化物分别为NaOH、Mg(OH)2、Al(OH)3中,碱性最强的化合物是NaOH;
(3)①②③三种元素为Na、K、Mg,其原子半径由大到小的顺序是K>Na>Mg;
(4)最高价氧化物对应的水化物既能与酸反应生成盐和水,又能和碱反应生成盐和水,该元素为Al。在这两种盐中铝的化合价均为+3价,铝元素的最高价氧化物为Al2O3,其与盐酸反应的离子方程式为Al2O3+6H+=2Al3++3H2O。向AlCl3溶液中,缓慢滴加氢氧化钠溶液至过量,实验现象是:先产生白色沉淀,后沉淀逐渐溶解消失。有关反应的化学方程式为AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O;
II.分析所给物质中含有的化学键可知,N2中只有非极性键,CO2中只有极性共价键,NH3中只有极性共价键,Na2O中只有离子键,Na2O2中既有离子键,又有非极性共价键;NaOH中既有离子键,又有极性共价键;CaBr2中只有离子键,H2O2中既有极性共价键,又有非极性共价键,NH4Cl中既有离子键,又有极性共价键;Ar中没有化学键。所以:
(1)既含有极性键又含有非极性键的是⑧;
(2)含有非极性键的离子化合物是⑤;
(3)不含化学键的是⑩。


科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述不正确的是( )
2AlN+3CO合成。下列叙述不正确的是( )
A.AlN中N元素显-3价B.上述反应中CO是氧化产物
C.上述反应中Al2O3是还原剂D.上述反应中碳发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒温恒容密闭容器中反应,达到平衡状态的标志是
在恒温恒容密闭容器中反应,达到平衡状态的标志是
![]() 单位时间内生成n
单位时间内生成n![]() 的同时消耗2n
的同时消耗2n![]() ;
;
![]() 单位时间内生成n
单位时间内生成n![]() 的同时消耗2nmolNO;
的同时消耗2nmolNO;
![]() 混合气体的颜色不再改变的状态;
混合气体的颜色不再改变的状态;
![]() 混合气体中
混合气体中![]() 不变;
不变;
![]() 的消耗速率与NO的生成速率相等;
的消耗速率与NO的生成速率相等;
![]() 容器内压强不随时间变化而变化。
容器内压强不随时间变化而变化。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车等机动车尾气,含(CO、NO等)是城市空气的污染源。利用NSR技术可有效降低CO、NO的排放,回答有关问题:
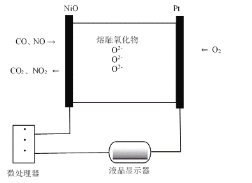
I.CO、NO的检测
(1)O2-的移动方向为__________。(填“向Pt电极”或“向NiO电极”)
(2)NiO电极上的电极反应为___________和__________。
II.NSR处理技术
NO的储存和还原在不同时段交替进行,实现两种有害气体,同时被处理,工作如图所示。
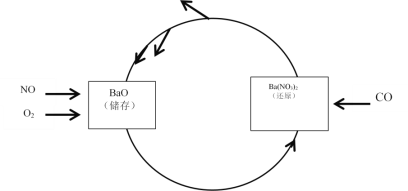
(3)已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5 kJ/mol ①
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ/mol ②
则NSR技术工作原理的热化学方程式:2CO(g)+2NO(g)=N2(g)+2CO2(g)③的ΔH=________
(4)在一定温度下,向2L恒容密闭容器中充入等物质的量的NO和CO,发生反应,反应过程中c(NO)随时间的变化曲线如图所示。
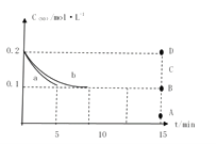
①图中曲线a或b中表示在该温度下使用NSR催化技术的是__________。
②曲线b中前10min内CO的平均反应速率v(CO)=_________;此温度下该反应的平衡常数K为_______。若平衡后,再向容器中充入CO和N2各0.8mol,则此时v(正)_____ v(逆)(填“>”、“<”或“=”)。
③若保持其他条件不变,15min时将容器的体积压缩至1L,20min时反应重新达到平衡,NO的物质的量浓度对应的点可能是____点。(填字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaBiO3可作为钢铁分析中测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备。其工艺流程如下:
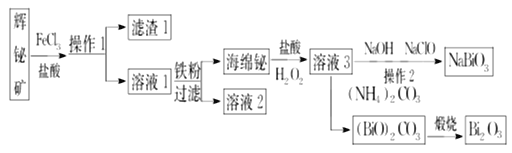
回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3溶液反应的离子方程式:______,滤渣1的主要成分是__________(填化学式)和硫。
(2)NaBiO3是为数不多的钠盐沉淀之一,由溶液3制得纯净的NaBiO3,操作2包括_____________。
(3)Bi2O3与Na2O2可在熔融状态下反应制得NaBiO3,其副产物的化学式为________________。
(4)写出“煅烧”中由碱式碳酸铋[(BiO)2CO3]制备Bi2O3的化学方程式: ____________。
(5)某工厂用m1 kg辉铋矿(含Bi2S3 60%)制备NaBiO3,最终得到产品m2 kg,产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学无处不在,下列说法错误的是( )
A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应:N2+O2 ![]() 2NO
2NO
B. 根据化学学科核心素养之一(证据推理与模型认知)可推知Cr(OH)3胶体也可吸附悬浮杂质
C. 纳米铁粉可以高效地去除污水中的重金属离子是因为其具有较强的还原性
D. 位于贵州省平塘县的中国天眼FAST使用的SiC是一种有机材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是( )

A.该反应可能在酸性条件下进行
B.生成物微粒只有S2-、H2O
C.氧化产物与还原产物的物质的量之比为2:1
D.0.3molS参加反应时,转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应可以用如图表示,下列有关置换反应的说法错误的是
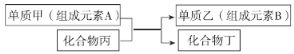
A.若乙是一种常见半导体材料,工业上利用上述反应制取乙的化学方程式为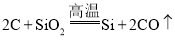
![]()
B.若甲是铝,丙是![]() ,过量的甲与丙反应后,可加入足量的NaOH溶液充分反应后,过滤,将产物乙分离出来
,过量的甲与丙反应后,可加入足量的NaOH溶液充分反应后,过滤,将产物乙分离出来
C. ![]() 和
和![]() 可发生置换反应,将等物质的量的
可发生置换反应,将等物质的量的![]() 、
、![]() 混合,充分反应,被氧化的B元素与未被氧化的B元素质量之比是1∶1
混合,充分反应,被氧化的B元素与未被氧化的B元素质量之比是1∶1
D.若甲是Cu,乙是![]() ,设计电解池实现该置换反应,则铜片为阳极
,设计电解池实现该置换反应,则铜片为阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com