

 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.分析 (1)乙酸与乙醇在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯与水;
(2)空气中含有水蒸气,因此装置中加干燥管是为了防湿气进入反应体系中以保证反应体系干燥;
(3)反应装置中冷凝管的作用是冷凝回流,挺高原料的利用率,减压装置中冷凝管的作用是冷却蒸发出的蒸汽便于得到产品;为充分冷凝,使冷水充满冷凝器,因此冷却水采取逆流原理;
(4)由于产物中含有钠盐,因此产物处理后,滴加稀醋酸的目的是中和生成的钠盐,使之变成产物;酯类在碳酸钠溶液中的溶解度小,滴加碳酸钠溶液可以除去混有的乙酸;碳酸钾吸水,因此加碳酸钾的目的是干燥产品;
(5)根据反应物的用量可知钠不足,因此理论上生成产品的物质的量是0.07mol,根据m=nM计算理论上3-丁酮酸乙酯质量,进而计算其产率.
解答 解:(1)实验室制取乙酸乙酯的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,
CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;酯化反应;
CH3COOCH2CH3+H2O;酯化反应;
(2)空气中含有水蒸气,因此装置中加干燥管是为了防湿气进入反应体系中以保证反应体系干燥,故答案为:防湿气进入反应体系中以保证反应体系干燥;
(3)反应装置中冷凝管的作用是冷凝回流,挺高原料的利用率,减压装置中冷凝管的作用是冷却蒸发出的蒸汽便于得到产品,为充分冷凝,使冷水充满冷凝器,冷却水进水口分别为b和d,
故答案为:不相同;b、d;
(4)由于产物中含有钠盐,因此产物处理后,滴加稀醋酸的目的是中和生成的钠盐,使之变成产物,由于酸多了会增加产物在水中的溶解度,醋酸不能滴加的过多;
酯类在碳酸钠溶液中的溶解度小,除去酯中的醋酸,需要滴加碳酸钠溶液;
碳酸钾吸水,因此加碳酸钾的目的是干燥产品,
故答案为:中和生成的钠盐,使之变成产物;除去酯中的醋酸;干燥产品;
(5)根据反应物的用量可知钠不足,因此理论上生成产品的物质的量是0.07mol,其质量是0.07mol×130g/mol=9.1g,所以产率是$\frac{2.0g}{9.1g}$×100%=22%,故答案为:C.
点评 本题考查了物质制备方案的设计、对装置与操作的分析评价、物质的分离提纯、产率的计算,试题充分考查了学生的分析能力、理解能力及化学实验能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | .①②③ | B. | .②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )
实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示.下列分析正确的是( )| A. | 操作Ⅰ是过滤,将固体分离除去 | |
| B. | 操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠 | |
| C. | 操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 | |
| D. | 操作Ⅰ~Ⅲ总共只需一次过滤操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
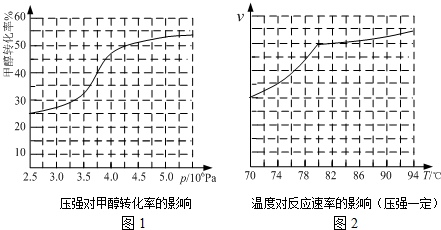
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | m 小于n |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com