
【题目】今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)
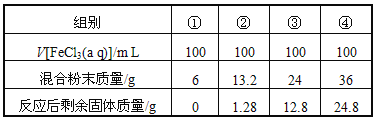
有关说法不正确的是( )
A. 第①组溶液中c(Fe3+)=2.0 mol/L
B. 第②组剩余固体只有铜
C. 第③④组反应后的滤液中c(Fe2+)=6 mol/L
D. 原混合粉末中n(Fe):n(Cu)=11:9
【答案】D
【解析】分析:金属性Fe>Cu,氯化铁首先氧化金属铁,然后再氧化金属铜,结合固体质量的变化、反应的方程式分析解答和计算。
详解:每一组中氯化铁均是0.4mol,从②组数据中可以得出,FeCl3溶液全部参与反应,假设只发生反应为Fe+2Fe3+=3Fe2+,则溶解的Fe的质量为11.2g,13.2-1.28=11.92>11.2,所以同时也有一部分Cu溶解发生反应:Cu+2Fe3+=Fe2++Cu2+,则剩余的固体全部为Cu;利用②的数据,设Fe、Cu合金中金属物质的量分别为xmol、ymol,则
Fe+2Fe3+=3Fe2+
1 2
x 0.2x
Cu+2Fe3+=Cu2++2Fe2+
1 2
0.2-x 0.4-0.2x
依据铜元素守恒(0.2-x)+1.28÷64=y;质量守恒56x+64y=13.2,解得:x=y=0.11,即铜与铁物质的量比是1:1,D错误。
利用③的数据,正好是24-11.2=12.8,所以只发生了Fe+2Fe3+=3Fe2+,剩余的12.8全部为Cu,所以n(Fe):n(Cu)=![]() =1:1,符合铁和铜的物质的量之比,B正确;
=1:1,符合铁和铜的物质的量之比,B正确;
①组,6g固体中含有Cu、Fe的物质的量各为0.05mol
Fe+2Fe3+=3Fe2+
1 2 3
0.05 0.1 0.15
Cu+2Fe3+=Cu2++2Fe2+
1 2 1 2
0.05 0.1 0.05 0.1
c(Fe3+)=![]() =2.0mol/L,A正确;
=2.0mol/L,A正确;
③组中生成亚铁离子是0.6mol,浓度是6.0mol/L;根据③组实验可知④组中只有铁被溶解,剩余的金属是铁和铜混合物,三价铁全部反应,根据铁元素守恒可知,0.4molFe3+全部反应生成0.6molFe2+,所以反应后溶液中亚铁离子的浓度为6mol/L,C正确;答案选D。


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:
【题目】煅烧铵明矾晶体时发生的主要反应为:4[NH4Al(SO4)2·12H2O] ![]() 2Al2O3+N2↑+2NH3↑+3SO2↑+53H2O+5SO3↑,将产生的气体通过如图所示的装置(广口瓶中的试剂均足量)。
2Al2O3+N2↑+2NH3↑+3SO2↑+53H2O+5SO3↑,将产生的气体通过如图所示的装置(广口瓶中的试剂均足量)。
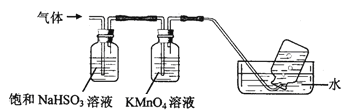
(1)集气瓶中最终收集到的气体是______ (填化学式,下同)。
(2)通过足量饱和NaHSO3溶液后大量减少的气体有______ 。
(3)KMnO4溶液颜色逐渐褪去,发生反应的离子方程式为______ 。
(4)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,反应后溶液中溶质的成分不可能是______ (填字母)。
A.(NH4)2SO4、Al2(SO4)3 B.(NH4)2SO4
C.(NH4)2SO4、Ba(AlO2)2 D.(NH4)2SO4、Al2(SO4)3、Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是
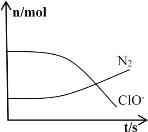
A. 该反应中Cl-为氧化产物
B. 消耗1mol还原剂,转移6mol电子
C. NH4+被ClO-氧化成N2
D. 反应后溶液的酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组同学欲利用CuO与NH3的反应来研究NH3的某种性质并测定其组成,设计的实验装置如图所示(夹持装置已省略)。
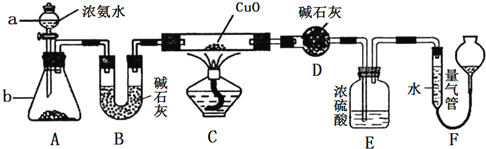
请回答下列问题:
(1)仪器a的名称为______________;仪器b中盛装的试剂为__________________(填名称)。
(2)实验中观察到装置C中黑色CuO粉末变为单质铜,且量气管中有气体单质产生,上述实验现象证明NH3具有____________性,写出相应的化学方程式:_________________________。
(3)装置E中浓硫酸的作用是_________________________________。
(4)实验结束后,若测得干燥管D增重mg,装置F中气体的体积为nL(已折算为标准状况),则氨分子中氮、氢的原子个数比为___________(用含m、n的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗痫灵(题中编号为G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(反应条件和副产物已略):
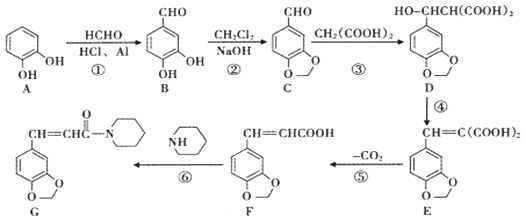
(1)F中官能团名称是__________________________________;合成路线的反应中为加成反应的是_________(填反应序号);
(2)若以醛基为母体,则B的系统命名法的名称为__________________________;
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应;b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种
则H的结构简式为____________________________________;
(4)写出反应⑥的化学反应方程式:___________________________________;
(5)请以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),设计合成路线合成分子
)为起始原料(其余有机、无机原料任选),设计合成路线合成分子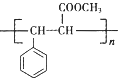 ________________________________________________。
________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分別取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液変红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分別取2mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______(填离子符号);实验①和实验③说明:在I-过量的情况下,溶液中仍含有_____(填离子符号);由此可以证明该氧化还原反应为___________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________。生成沉淀的原因是______________(用平衡移动原理解释)。
(6)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液通入标准状况下112mLCl2,恰好将Fe2+完全氧化,则x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为氧化产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
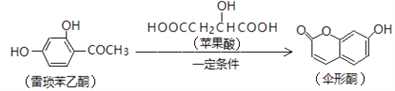
下列说法中正确的是
A. 1mol雷琐苯乙酮最多能与3mol Br2发生取代反应
B. 苹果酸能形成一种缩聚产物是![]()
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com