
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
分析 Ⅰ.(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金;
(2)根据铝与NaOH溶液反应的性质设计实验方案;
(3)A.浓硫酸易使铁、铝钝化,不能使合金溶解;
B.活泼金属与稀硫酸反应;
C.稀硝酸与金属反应生成污染性气体;
D.铁不与NaOH溶液反应;
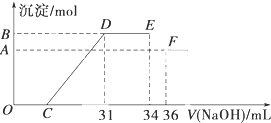
Ⅱ.(1)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,以此书写离子方程式;
(2)D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,以此书写离子方程式;根据反应顺序确定结合OH-的能力;
(3)B与A的差值为氢氧化铝的物质的量,由EF段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;
(4)B与A的差值为氢氧化铝的物质的量,由EF段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;再根据电子守恒计算出铁的物质的量,据此可以计算出沉淀氢氧化铝、氢氧化铁的物质的量;再根据31mL时反应情况计算出C点氢氧化铁溶液体积.
解答 解:Ⅰ.(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,所以铝热反应所得到的熔融物应是铁铝合金,
故答案为:合理;
(2)铝与NaOH溶液反应生成气体,反应的化学方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,所以可用NaOH溶液检验所得的块状熔融物中含有金属铝,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)A.浓硫酸易使铁、铝钝化,不能使合金溶解,故A错误;
B.活泼金属与稀硫酸反应,熔融物可溶解于稀硫酸中,故B正确;
C.稀硝酸与金属反应生成污染性气体,不是最佳选择,故C错误;
D.铁不与NaOH溶液反应,不能将熔融物全部溶解,故D错误;
故答案为:B;
Ⅱ.(1)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
故答案为:H++OH-═H2O;
(2)D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为NH4++OH-═NH3•H2O,
上述现象说明溶液中最先结合OH-是氢离子,最后结合OH-是铵根离子,所以溶液中Al3+、Fe3+、H+离子结合OH-的能力强于铵根离子,
故答案为:NH4++OH-═NH3•H2O; Al3+、Fe3+、H+;NH4+;
(3)由图可知,EF段消耗的氢氧化钠溶液为36mL-34m=2mL,故该计算参加反应的氢氧化钠为0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol,
故答案为:0.008;
(4)由图可知,EF段消耗的氢氧化钠溶液为36mL-34m=2mL,故该计算参加反应的氢氧化钠的物质的量为:0.002L×4mol/L=0.008mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.008mol;金属混合物中含有铝0.008mol;
设铁为xmol,Al为0.008mol,生成硝酸铵为:(34-31)×0.001L×4mol/L=0.012mol,由于显示过量,铁反应生成了硝酸铁,由电子守恒可知,3x+0.008×3=0.012×8,解得x=0.024mol,即反应生成氢氧化铁的物质的量为0.024mol,生成沉淀的总物质的量为:0.008mol+0.024mol=0.032mol;
滴加NaOH体积为31ml时,发生反应为①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,则C点氢氧化钠溶液的体积为31mL-$\frac{0.024mol×3}{4mol/L}$×1000mL/L-$\frac{0.008mol×3}{4mol/L}$×1000mL/L=7mL,
故答案为:0.032;7.
点评 本题考查铝热反应、金属与硝酸的反应,涉及离子方程式的书写、氧化还原反应、化学计算等知识点题目,题目难度较大,注意明确图中各阶段发生反应的实质,能够正确判断出硝酸的还原产物为解题关键.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu2+、H+、Cl- | B. | Na+、CO32-、Cl- | C. | Na+、H+、Cl- | D. | Na+、OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不需要加热就能发生的反应一定是放热反应 | |
| B. | 弱电解质溶液的导电能力一定比强电解质溶液的弱 | |
| C. | SO2溶于水,其水溶液能导电,故SO2是电解质 | |
| D. | 升高温度,可提高活化分子百分数,使有效碰撞增多,化学反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  根据图可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H<0 | |
| B. |  如图表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. |  如图可表示醋酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. |  如图④是N2与H2合成氨的能量变化曲线,可确定该反应1mol N2和4molH2充分反应时放热一定等于92kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 透明的水溶液中:K+、Mg2+、SO42-、MnO4- | |
| B. | 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| C. | 在pH=7的溶液中:Na+、Fe3+、SO42-、Br- | |
| D. | 强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com