
某化学兴趣小组模拟工业上从铝土矿(主要成分是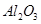 ,含
,含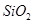 、
、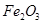 等杂质)中提取氧化铝的工艺做实验,流程如下:
等杂质)中提取氧化铝的工艺做实验,流程如下: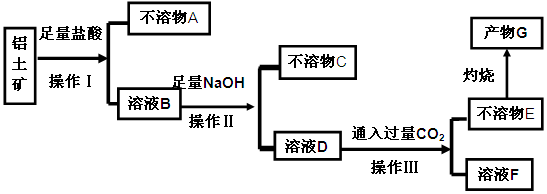
请回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ的名称为 。
(2)验证溶液B中是否含有Fe3+的方法: 。
(3)不溶物A是 (填化学式),写出D→E反应的离子方程式 。
(4)说出溶液F中含碳元素溶质的一种用途 。
(1)过滤(2分)
(2)取少量溶液B于试管中,加入少量KSCN溶液,若溶液变成红色,则溶液B中含有Fe3+ (2分)
(3)SiO2(2分)AlO2―+2H2O+CO2=HCO3―+Al(OH)3↓(2分)
(4)发酵粉 治疗胃酸过多等(2分)
解析试题分析:加入盐酸后,铝土矿中的Al2O3、Fe2O3、MgO能和盐酸反应,而SiO2不能溶解,即不溶物A是SiO2,操作Ⅰ是过滤;所得的滤液B有氯化铝、氯化铁、氯化镁以及过量的盐酸,向其中加过量的烧碱,所得不溶物C为Mg(OH)2 Fe(OH)3,操作Ⅱ也是过滤, 所得滤液D的主要成分为偏铝酸钠,通入过量CO2的化学方程式为NaA1O2+CO2+H2O=Al(OH)3 ↓+NaHCO3,操作Ⅲ也是过滤,将它们分离,不溶物E为Al(OH)3,灼烧后生成产物G为Al2O3,(1)操作Ⅰ、Ⅱ、Ⅲ的名称为过滤,答案:过滤。(2)验证溶液B中是否含有Fe3+的方法:取少量溶液B于试管中,加入少量KSCN溶液,若溶液变成红色,则溶液B中含有Fe3+ 。答案:取少量溶液B于试管中,加入少量KSCN溶液,若溶液变成红色,则溶液B中含有Fe3+ 。(3)不溶物A是SiO2,写出D→E反应的离子方程式:AlO2―+2H2O+CO2=HCO3―+Al(OH)3↓,答案:SiO2(2分)AlO2―+2H2O+CO2=HCO3―+Al(OH)3↓(2分);(4)NaHCO3,可以制纯碱或做发酵粉、治疗胃酸过多等,答案;发酵粉 治疗胃酸过多等。
考点:制备实验方案的设计;离子方程式的书写


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:填空题
下列物质之间有如下反应关系: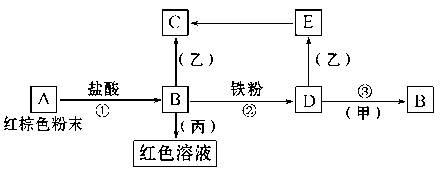
已知由E转化成C的现象是:白色沉淀迅速变为灰绿色,最后变为红褐色。回答:
(1)写出下列物质的化学式:甲________,丙________。
(2)写出E→C反应的化学方程式:___________________________。为了获得E,可以用新配制的D溶液与用不含O2的蒸馏水配制的乙溶液反应制备。
(3)用相应晶体配制上述D溶液时你觉得还需加入 。
(4)写出Fe与H20在一定条件下反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: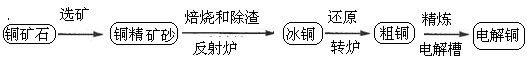
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。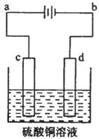
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用,利用铝热反应完成钢轨的焊接非常方便迅速。完成下列填空:
(1)在特制漏斗中将铝热剂混合均匀后,引发铝热反应的操作是: ;
(2)硅与铝同周期。地壳里硅、铝的含量硅 铝(填>,<或=)。SiO2是硅酸盐玻璃(Na2CaSi6O14)主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。钠长石(NaAlSi3O8)的氧化物形式 ,长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由此可推知钙长石的化学式为 ;
(3)某铝合金由Al、Si、Cu、Mg组成。①称取100g该铝合金样品,分成等质量的A、B两份。向A份加入足量NaOH溶液,B份加入足量的稀盐酸。②待两份反应物都充分反应之后,称得滤渣质量相差1.60g,收集得到的两份气体的体积相差2240mL(标准状况下)。则样品中Si和Mg的物质的量分别是 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜及其化合物在生产生活中有广泛应用,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜,温度控制在50℃-60℃的两个原因除了加快反应速率外,还有 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式 。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO, 其猜想可用化学方程式表示为:
Cu + H2SO4
②乙同学认为:黑色固体除CuO外还可能含有Cu2S和CuS.其理由可能是 (填字母)
a.Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价上升与S的化合价下降有多种可能
(4)现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。Cu2O跟稀硝酸反应的离子方程式 。若将上述混合物用足量的H2加热还原,所得到固体的质量为 g。若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上通常以铝土矿(主要成分为Al2O3)为原料制备无水氯化铝:2Al2O3+6Cl2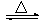 4AlCl3+3O2 ↑。请回答下列问题:
4AlCl3+3O2 ↑。请回答下列问题:
(1)上述反应涉及的元素中,最外层有2个未成对电子的元素是__________;简单离子的离子半径最小的元素,其原子核外有_____种不同能级的电子。
(2)已知元素周期表中,镓(31Ga)与铝元素同一主族,写出Ga的最外层电子排布式:______
(3)镓(Ga)有两种天然同位素,一种是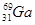 ,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。
,其原子在天然同位素原子中所占的百分比为60%。实验测得溴化镓(GaBr3)的摩尔质量为309.8 g/mol,则由此推知镓的另一种同位素是_________。
(4)为促进反应的进行,实际生产中需加入焦炭,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是 。发生反应的离子方程式为 ;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为 。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
| 步骤 | 操作 | 现象及结论 |
| 1 | 用甲、乙两支试管分别取两种溶液各少许。 | |
| 2 | 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。 | |
| 3 | 。 | ,则甲是 ,乙是 。 ,则甲是 ,乙是 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二硫化亚铁是Li/FeS2电池的正极活性物质,可用水热法合成。FeSO4、Na2S2O3、S及H2O在200℃连续反应24小时,四种物质以等物质的量反应,再依次用CS2、H2O洗涤、干燥及晶化后得到。
(1)合成FeS2离子方程式为 。
(2)用水洗涤时,如何证明S042-己除尽 。
(3)己知1.20gFeS2在O2中完全燃烧生成Fe2O3和SO2气体放出8.52kJ热量,FeS2燃烧反应的热化学方程式为 。
(4)取上述制得的正极材料1.1200g (假定只含FeS一种杂质),在足量的氧气流中充分加热,最后得0.8000g红棕色固体,则该正极材料中FeS2的质量分数(写出计算过程)。
。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(7分)现有22g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与200mL含有一定质量的20%硫酸溶液恰好完全反应,得到无水盐70g,求(要求写出计算过程)
(1)硫酸溶液的质量?
(2)生成的气体体积(标准状况)?
(3)硫酸物质的量浓度?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com