
【题目】过氧化尿素的化学式为CO(NH2)2H2O2,是过氧化氢和尿素的加合物,外观为白色针状晶体,无毒无味,热分解温度为 45℃,易溶于水和乙醇,熔点 75-85℃,其水溶液兼有尿素和过氧化氢的性质,具有活性氧含量高、稳定性好等特点,被广泛用于医药、纺织领域。已知尿素与KMnO4溶液、NaOH 溶液都不反应。
I.合成过氧化尿素的流程及反应器的示意图如下:
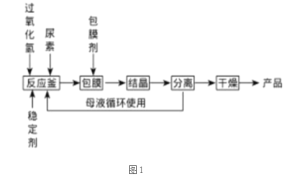
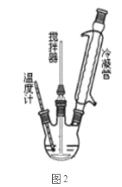
回答下列问题:
(1)图1中分离操作的名称为 _______,图 2 中反应器的名称是 _______;
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过_________(填字母)结合形成的。
A.氢键 B.共价键 C.离子键 D.化学键
反应器中发生反应的化学方程式为____________。
(3)工业生产中,除向反应釜中投料反应物过氧化氢、工业尿素(含少量杂质铁、铜等离子)外,添加稳定剂可以提高产品的稳定性。不加稳定剂导致产品稳定率差的原因是 __。
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 2.500g,溶解于水,在250mL 容量瓶中定容,准确量取其中 25.00mL 溶液于锥形瓶中,加入1mL6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2,三次滴定平均消耗KMnO4溶液 8.000mL。
①达到滴定终点的现象是____________。
②根据滴定结果确定产品质量_(填“合格”或“不合格”),活性氧的质量分数为___。
II.过氧化尿素的性质探究:
(5)过氧化尿素的催化分解实验:在试管中加入 0.1g 产品、少量水及二氧化锰,用火柴余烬检验生成气体,可观察到火柴复燃。实验中加入二氧化锰的量一定要少(固体控制在小米粒大小)的原因是:_________。
(6)测定过氧化尿素溶液的酸碱性:在试管中加入1mL 6mol/L NaOH溶液、1mL过氧化尿素溶液和 2mL无水乙醇,振荡试管。测得pH约为6,并观察到有白色的胶状沉淀生成,该沉淀为生成的NaHO2在乙醇中析出。写出该反应的化学方程式:___
【答案】过滤 三颈烧瓶 A CO(NH2)2+H2O2=CO(NH2)2·H2O2 铁、铜离子等会催化过氧化氢分解 滴入最后一滴 KMnO4 标准溶液时,溶液恰好变为浅红色,且半分钟内不褪色 不合格 12.80% 以防由于分解速度过快使反应液喷溅到试管外 NaOH+H2O2=NaHO2+H2O
【解析】
(4)该滴定实验的目的是测定过氧化尿素中活性氧的含量,尿素不与酸性高锰酸钾反应,所以利用高锰酸钾标准液滴定样品中H2O2的含量来确定活性氧的含量,滴定过程中高锰酸钾被H2O2还原,发生反应5H2O2+2KMnO4+3H2SO4=8H2O+2MnSO4+K2SO4+5O2↑。
(1)分离后得到固体产品和母液,所以分离操作为过滤;反应器的名称为三颈烧瓶;
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过氢键结合形成,共价键、离子键不是分子间作用力,氢键不属于化学键,所以选A;
反应器中的反应物有尿素和过氧化氢,产物为过氧化尿素,根据元素守恒可得化学方程式为CO(NH2)2+H2O2=CO(NH2)2·H2O2;
(3)工业尿素中含有铁、铜等杂质离子,不添加稳定剂,铁、铜离子等会催化过氧化氢分解,导致产品稳定率差;
(4)①达到滴定终点时H2O2完全反应,再滴入高锰酸钾不再反应,溶液会显浅红色,所以滴定终点的现象为:滴入最后一滴 KMnO4 标准溶液时,溶液恰好变为浅红色,且半分钟内不褪色;
②高锰酸钾溶液的浓度为0.1000mol/L,消耗的体积为8.000mL,根据发生的反应方程式可知25.00mL样品溶液中n(H2O2)=![]() ×0.1000mol/L×0.008L=0.002mol,则样品中n(H2O2)=0.002mol×
×0.1000mol/L×0.008L=0.002mol,则样品中n(H2O2)=0.002mol×![]() =0.02mol,所以样品中活性氧的含量为
=0.02mol,所以样品中活性氧的含量为![]() =12.80%<16%,所以产品不合格;
=12.80%<16%,所以产品不合格;
(5)二氧化锰的量过大会使过氧化氢的分解速率过快,所以加入二氧化锰的一定要少的原因是:以防由于分解速度过快使反应液喷溅到试管外;
(6)根据题目信息可知尿素不与NaOH反应,所以生成的NaHO2应该是H2O2和NaOH反应的产物,根据元素守恒可得化学方程式为NaOH+H2O2=NaHO2+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室常用王水(浓硝酸和浓盐酸按体积比1:3的混合物)来溶解白金等贵金属进行科学实验。王教授用质量分数为63%的浓硝酸(密度1.40g/ ![]() )和质量分数为36.5%的浓盐酸(密度1.19g/
)和质量分数为36.5%的浓盐酸(密度1.19g/ ![]() )来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
)来配制王水600毫升,假设忽略两种酸混合时的体积变化也不考虑混合后的化学变化,下列说法错误的是
A. 该王水中硝酸的物质的量浓度是3.5mol/L
B. 该王水中氧元素的质量是100.8g
C. 该王水的密度约为1.24g/ ![]()
D. 该王水中HCl的质量分数约为26.2%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】增塑剂DCHP可由邻苯二甲酸酐与环己醇反应制得。
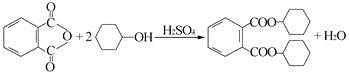
邻苯二甲酸酐 DCHP
下列说法正确的是
A.邻苯二甲酸酐的二氯代物有3种
B.环己醇分子中所有的原子可能共平面
C.DCHP能发生加成、取代、消去反应
D.1 mol DCHP最多可与含2 mol NaOH的溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电化学的叙述正确的是( )
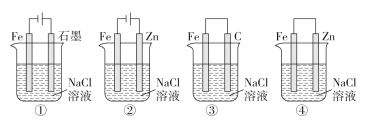
A. 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红
B. 图②装置中Fe电极参与反应发生腐蚀
C. 图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH-
D. 上述4个装置中,图①、②中Fe腐蚀速率较快,图③中Fe腐蚀速率较慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
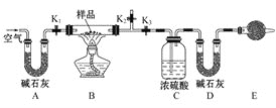
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是__________。
②称取样品,并将其放入硬质玻璃管中,称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为________、________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是_______________。
②E处干燥管中盛放的药品是碱石灰,其作用是_____________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量_____________(填“偏大”“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1g、m2g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于实验室制备乙烯的下列说法中,正确的是( )
①烧瓶中加入碎瓷片防止温度过高,受热均匀 ②烧瓶里注入酒精和浓硫酸(体积比1:3)混合均匀 ③温度计下端伸入液体内部,且不接触瓶底 ④加热时使温度缓慢上升至170度 ⑤加入的浓硫酸在反应中只起吸水剂的作用
A.①②B.④⑤C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2 ![]() 2NH3 的能量变化如图所示,该反应的热化学方程式是
2NH3 的能量变化如图所示,该反应的热化学方程式是
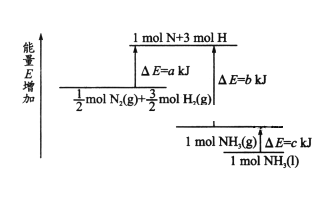
A. N2(g)+3H2(g)=2NH3(l) ![]() =2(a-b-c)kJ/mol
=2(a-b-c)kJ/mol
B. N2(g)+3H2(g)=2NH3(g) ![]() =2(b-c)kJ/mol
=2(b-c)kJ/mol
C. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(b+c-a)kJ/mol
=2(b+c-a)kJ/mol
D. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(a+b)kJ/mol
=2(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com