
| A、大理石溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O |
| C、向澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D、氨水中通入过量二氧化硫:2NH3?H2O+SO2=2NH4++SO32-+2H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
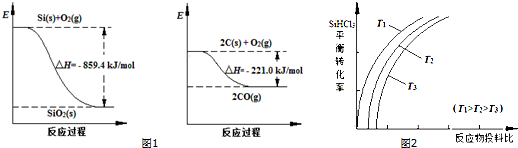
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NH4HCO2 | 11.9 | 15.8 | 21.0 | 27.0 | -* | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2+2H2O+Cl2=H2SO4+2HCl |
| B、SO2+2NaOH=Na2SO3+H2O |
| C、SO2+2H2S=2H2O+3S↓ |
| D、SO2+PbO2=PbSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钡溶液与硫酸的反应 OH-+H+=H2O |
| B、金属钠与水反应 Na+H2O=Na++OH-+H2↑ |
| C、铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
| D、碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| OH- |
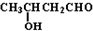
| -H2O |
| △ |

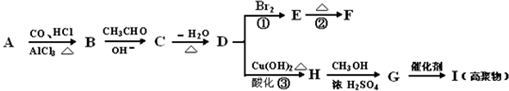

查看答案和解析>>
科目:高中化学 来源: 题型:
| 8 |
| 9 |
| A、1:1:0 |
| B、6:9:0 |
| C、3:4:1 |
| D、3:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
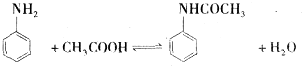

| 试剂名称 | 相对分子质量 | 密度g/mL | 熔点℃ | 沸点℃ | 溶解度 |
| 苯胺 | 93 | 1.02 | -6.2 | 184.4 | 稍溶于水,与乙醇、乙醚、苯混溶 |
| 乙酸 | 60 | 1.05 | 16.7 | 118 | 溶于水、乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 1.21 | 114~116 | 280~290 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com