
| 温度 | Na2S2O3溶液的体积和浓度 | H2SO4溶液的体积和浓度 | |
| A | 50℃ | 5mL 0.5mol•L-1 | 5mL 0.5mol•L-1 |
| B | 50℃ | 50mL 0.1mol•L-1 | 50mL 0.1mol•L-1 |
| C | 50℃ | 10mL 0.2mol•L-1 | 10mL 0.2mol•L-1 |
| D | 50℃ | 15mL 0.1mol•L-1 | 15mL 0.1mol•L-1 |
| A. | A | B. | B | C. | C | D. | D |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 奥运火炬燃烧主要是将化学能转变为热能和光能 | |
| B. | 丙烷的沸点比正丁烷高 | |
| C. | 丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的负极 | |
| D. | 丙烷与甲烷属同系物,也无同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
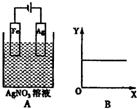
| A. | c (Ag+) | B. | 溶液的pH | C. | Ag棒的质量 | D. | c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 直线 sp杂化 | B. | V型 sp杂化 | ||
| C. | 三角锥形 sp2杂化 | D. | 平面三角形 sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯滴入溴水中,振荡后水层接近无色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 乙烯使溴的四氯化碳溶液褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
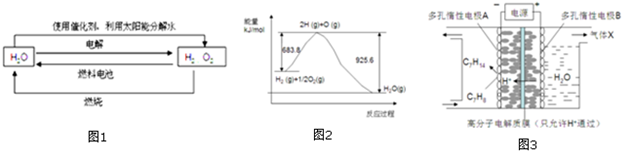
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
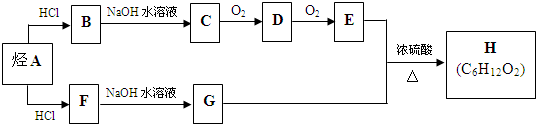
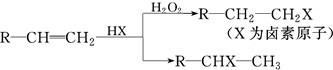
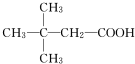 .(用结构简式表示)
.(用结构简式表示) .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
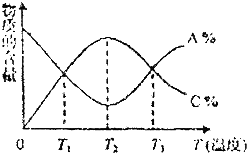
| A. | 该反应在T1、T3温度时达到过化学平衡 | |
| B. | 该反应的正反应是吸热反应 | |
| C. | 该反应在T2温度时达到过化学平衡 | |
| D. | 升高温度,平衡会向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com