
 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.分析 (1)自发的氧化还原反应才能设计成原电池;
(2)①甲装置符合原电池构成条件,所以是原电池,乙不能形成闭合回路,所以不能构成原电池,两个烧杯中,锌都失电子发生氧化反应,甲中铜上氢离子得电子发生还原反应,乙中锌上氢离子得电子发生还原反应;
②作原电池负极的金属加速被腐蚀;
③原电池负极的金属失电子发生氧化反应,依据原电池中阴离子流向负极及据硫酸根离子未参与电极反应判断其浓度.
解答 解:(1)反应A.NaOH+HCl=NaCl+H2O不是氧化还原反应,不能设计成原电池,反应B.Zn+H2SO4=ZnSO4+H2↑是氧化还原反应,能设计成原电池,
故答案为:不能;能;
(2)①甲装置是原电池,发生电化学腐蚀,乙装置发生化学腐蚀.
a、甲是化学能转变为电能的装置,乙不是,故a错误;
b、乙装置中铜片不反应,也没构成原电池的正极,所以铜片上没有明显变化,故b正确;
c、甲、乙中锌片质量都减少,故c错误;
d、两个烧杯中都产生氢气,氢离子浓度都降低,故d正确;
故选bd;
②原电池原理引起的腐蚀速度大于化学腐蚀的速度,故答案为:>;
③构成原电池的负极是锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,电池工作时,SO42-流向负极,由于硫酸根离子未参与电极反应,故反应完成后浓度不变,故答案为:Zn-2e-=Zn2+;负;不变.
点评 本题考查学生原电池的构成条件以及燃料电池的工作原理知识,属于综合知识的考查,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | A是原子的主族序数比B原子的主族序数大 | |
| B. | A原子的周期序数B原子的周期序数大 | |
| C. | 1mol A与酸反应置换出的H2比1mol B与酸反应置换出的H2多 | |
| D. | 把AB用导线连接后放入盛有稀硫酸的烧杯中,B上产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 该电池的负极材料为锌 | |
| B. | 该电池反应中二氧化锰发生了氧化反应 | |
| C. | 电池的正极反应式为MnO2+H2O+e-═MnOOH+OH- | |
| D. | 当有0.1 mol锌溶解时,流经电解质溶液的电子数为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
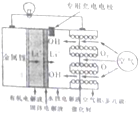 如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )
如图所示是一种新型的锂空气电池,该新型锂一空气电池无需充电,只需更换正极的水性电解液,通过卡盒等方式更换负极的金属锂就可以连续使用,正极生成的氢氧化锂可以从使用过的水性电解液中回收,再提炼出金属锂,金属锂则可再次作为原料循环使用,下列有关该锂电池的叙述不正确的是( )| A. | 放电时,锂离子(Li+)穿过固体电解质移到负极的水性电解液中 | |
| B. | 充电时,阳极的电极反应式为:4OH--4e-=O2+2H2O | |
| C. | 熔融的氢氧化锂用惰性电极电解再生时,在阴极可得到金属锂,放电时负极的电极反应式为:Li-e-=Li+ | |
| D. | 充电时,锂极与外电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(W)>r(Y)>r(Z)>r(X) | |
| B. | X、Y、Z三种元素形成的化合物中只有共价键 | |
| C. | 最高价氧化物对应水化物的酸性:W>Y | |
| D. | 气态简单氢化物的热稳定性:Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
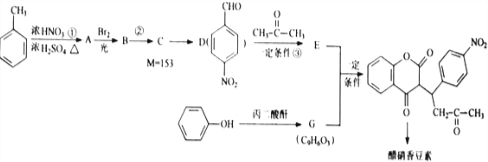
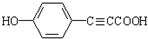
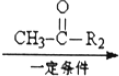 R1-CH=
R1-CH=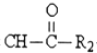 +H2O
+H2O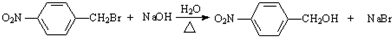 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、I2、Hg | B. | CO2、KCl、SiO2 | ||
| C. | HF、HCl、HBr | D. | CH4、C2H5OH、C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用铝热反应焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| B. | 用氯水除去FeCl3溶液中的Fe2+:Cl2+Fe2+═2Cl-+Fe3+ | |
| C. | 用已知浓度的NaOH溶液测定未知浓度的醋酸溶液的浓度:H++OH-═H2O | |
| D. | 盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2Na++2OH-═Na2SiO3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com