
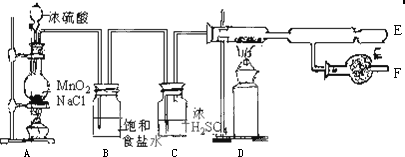
 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
分析 本题是利用四氢化萘的性质制备饱和氢溴酸溶液的实验探究,涉及根据反应物液溴和生成物溴化氢易挥发的特点选择反应装置D进行实验,通过滴加的液溴颜色不再褪去判断反应完全,考查了反应后混合物的分离与提纯,并结合产品的质量分数计算原料的配比,建议借助原子守恒进行计算,据此判断解答;
(1)根据①②的操作及使用试剂易挥发的特点判断合理的装置;
(2)液溴是深红褐色,最初滴入到反应容器内立即参与反应而褪色,如果进行完全,滴入的液溴将仍保留在反应容器内;
(3)根据步骤②需要加入了过量的液溴进行判断;
(4)根据四溴化萘常温下为固态和加入铁粉作催化剂考虑;
(5)饱和氢溴酸水溶液中氢溴酸的质量分数是66%,可设溶液的质量为100g,则溶液里HBr的质量为66g,可计算出其物质的量,再结合反应原理可推出四氢化萘的物质的量,从而可计算出四氢化萘与水的质量比.
解答 解:(1)按照步骤①,本实验是把四氢化萘、水和铁粉加入同一容器中反应,所以B不正确.若用A中的装置进行反应,溴蒸气和刺激性气味的四氢化萘都会污染环境,同样C装置在步骤②反应时,也会造成环境污染,所以A、C都不对,故选D装置,
故答案为:D;
(2)伴随反应的进行,最初滴入的红褐色液溴立即褪色,当反应完全后,滴入的液溴颜色不再褪去,
故答案为:加入的液溴颜色基本不褪;
(3)由于步骤②加入了过量的液溴,步骤③中补充少量四氢化萘除掉剩余的溴单质,
故答案为:除出去过量的Br2;
(4)由于生成的四溴化萘常温下为固态,所以过滤后得到的固体物质是四溴化萘和铁粉,
故答案为:四溴化萘和铁粉;
(5)设溶液的质量为100g,则溶液里HBr的质量为66g,水的质量为34g,HBr的物质的量$\frac{66g}{81g/mol}$=$\frac{22}{27}$mol,根据C10H12+4Br2?C10H8Br4+4HBr可知四氢化萘的物质的量为$\frac{22}{27}$mol÷4=$\frac{11}{54}$mol,质量为$\frac{11}{54}$mol×134g/mol=$\frac{737}{27}$g,则步骤①中四氢化萘和水的质量比约是$\frac{737}{27}$g:34g≈1:1.25,
故答案为:1.25.
点评 本题考查了用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,涉及了装置的选择、化学方程式的书写及配平,充分考查了学生的分析、理解能力及对所学知识掌握的熟练程度,本题难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1mol气体的体积只有在标准状况下才约是22.4L | |
| B. | 等质量的N2和N4,在不同条件下,所含氮原子数不同 | |
| C. | 22g某气体含分子数为0.5NA,则其摩尔质量为44 | |
| D. | 标准状况下1.12L CO和N2的混合气体含有约6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 )下列有关联苯的说法中正确的是( )
)下列有关联苯的说法中正确的是( )| A. | 分子中含有6个碳碳双键 | |
| B. | 1mol联苯最多可以和6molH2发生加成反应 | |
| C. | 它可以发生加成反应、取代反应,不易被酸性高锰酸钾氧化 | |
| D. | 它和蒽( )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 化学式 | N2 | O2 | CO2 | NH3 | Cl2 |
| 熔点(℃) | -209.86 | -218.4 | -78.5 | -77.3 | -101 |
| 沸点(℃) | -195.8 | -183 | -33.35 | -34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,平衡向正向移动,Kw不变 | |
| B. | 向水中加入少量NaOH固体,水电离的c(OH-)增大 | |
| C. | 向水中加入少量CH3COONa固体,平衡向正向移动,Kw增大 | |
| D. | 向水中加入少量NaHSO4固体,水的电离平衡向逆向移动,c(H+)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com