
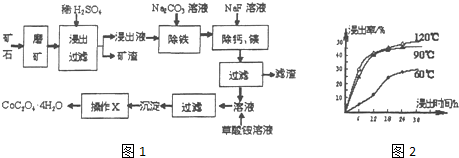
分析 水钴矿磨矿将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸,矿渣为SiO2,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙镁,过滤得主要含CoSO4的溶液,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴,
(1)根据浸出率与时间和温度的关系及生产成本分析,时间越长浸出率越高,温度越高,浸出率越高;
(2)根据原子守恒配平方程式,;
(3)依据溶度积常数计算,$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$×$\frac{c({F}^{-})}{c({F}^{-})}$=$\frac{Ksp(Ca{F}_{2})}{Ksp(Mg{F}_{2})}$;
(4)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,依据负极电极材料和题干信息分析计算.
解答 解:(1)根据图知,时间越长浸出率越高,温度越高,浸出率越高,但浸出12小时后,浸出率变化不大,90℃和120℃浸出率变化不大,且时间过长、温度过高导致成本较大,所以最佳的浸出时间为12小时,最佳的浸出温度为90℃,
故答案为:12;90;
(2)根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑,
故答案为:3,6,6,1,5,6;
(3)已知Ksp(CaF2)=1.11×10-10、Ksp(MgF2)=7.40×10-11,加入过量NaF溶液反应完全后过滤,则滤液中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$=$\frac{Ksp(Ca{F}_{2})}{Ksp(Mg{F}_{2})}$=$\frac{1.1×1{0}^{-10}}{7.40×1{0}^{-11}}$=1.5,
故答案为:1.5;
(4)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有SO42-、NH4+、Na+、F-,所以沉淀上含有SO42-、NH4+、Na+、F-,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,
故答案为:SO42-、NH4+、Na+、F-;洗涤、干燥;
(5)放电时,该电池是原电池,正极上得电子发生还原反应,电极反应式为:CoO2+Li++e-=LiCoO2,充电时,Li+还原为Li,并以原子形式嵌入电池负极材料碳-6(C6)中,所以负极为LiC6中Li的化合价为0价,若放电时有1mol e-转移,CoO2+Li++e-=LiCoO2,正极质量增加为1molLi+的质量=1mol×7g/mol=7g;
故答案为:0;7.
点评 本题考查难溶电解质的溶解平衡、电极反应式的书写、物质的分离和提纯等知识点,难点是(3)题,明确溶度积常数的含义是解此题关键,电极反应式的书写是学习难点,要结合电解质溶液的酸碱性书写,难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,v(正)变大,v(逆)变小 | |
| B. | 恒温恒容,平衡前后混合气体的密度保持不变 | |
| C. | 恒温恒压,充入N2,平衡不移动 | |
| D. | 恒温恒容,充入O2,O2的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测得0.05mol•L-1 H2SO4溶液的pH=1 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物一定为钾盐 | |
| C. | 滴定过程中,眼睛要始终注视锥形瓶中液体的颜色变化 | |
| D. | 配制FeSO4溶液时,先将FeSO4固体溶解在稀硫酸中,然后稀释到所需浓度,最后再加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +
+ $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$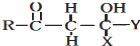
 CH2CH2CHO)的路线流程图.路线流程图示例如下:
CH2CH2CHO)的路线流程图.路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA | |
| B. | 标准状况下电解硫酸铜溶液时,阳极每生成气体3.36 L,转移电子数为0.6NA | |
| C. | 标准状况下,30gNO和16gO2混合所生成的气体分子数为NA | |
| D. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com