
【题目】仅用下表提供的用品(夹持仪器和试剂任选)能实现相应实验目的的是( )
选项 | 实验目的 | 仪器 |
A | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
B | 除去氢氧化铝胶体中的泥沙 | 半透膜、烧杯、玻璃棒 |
C | 用0.1000mol/L盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、胶头滴管、烧杯 |
D | 中和热的测定 | 烧杯、温度计、环形玻璃搅拌棒、泡沫塑料、硬纸板 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
甲同学:向1mol·L-1的FeCl3溶液中加少量NaOH溶液。
乙同学:直接加热饱和FeCl3溶液。
丙同学:向25mL沸水中逐滴加入5~6滴FeCl3饱和溶液;继续煮沸至溶液呈红褐色,停止加热。试回答下列问题:
(1)其中操作正确的同学是____。
(2)Fe(OH)3胶体制备的化学方程式为_____。
(3)证明有Fe(OH)3胶体生成利用的胶体性质是_____。
(4)利用Fe(OH)3胶体进行实验:
①将其装入U形管内,用石墨作电极,通电一段时间后发现与电源负极相连的电极附近的颜色逐渐变深,这表明Fe(OH)3胶体粒子带____(填“正”或“负”)电荷。
②若向其中加入浓盐酸溶液,产生的现象是_____,用必要的文字和有关的离子方程式解释此现象_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向10mL0.1molL-1HX溶液中逐滴加入0.2molL-1YOH溶液,混合溶液的pH变化情况如图所示(温度和体积变化忽略不计)。则下列结论错误的是( )
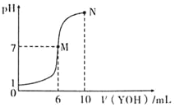
A.HX为一元强酸,YOH为一元弱碱
B.M点水的电离程度大于N点水的电离程度
C.N点对应溶液中粒子浓度:c(YOH)>c(Y+)>c(X-)>c(H+)>c(OH-)
D.25℃时pH=a的YX溶液中水电离出的c(H+)=1.0×10-amolL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是

A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于2—环己基丙烯(![]() )和2—苯基丙烯(
)和2—苯基丙烯(![]() )的说法中正确的是( )
)的说法中正确的是( )
A.二者均可使溴水、高锰酸钾褪色,且褪色原理相同
B.2—苯基丙烯分子中所有碳原子一定共平面
C.二者可与足量的氢气在一定条件下反应得到同一种产物,此产物的一氯代物有5种
D.二者可以通过加成聚合反应形成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:p=p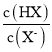 =-lg
=-lg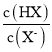 。室温下,向0.10mo1·L-1的HX溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH随p的变化关系如图。下列说法正确的是( )
。室温下,向0.10mo1·L-1的HX溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH随p的变化关系如图。下列说法正确的是( )

A.a点溶液中:c(HX)+c(X-)=0.10mo1·L-1
B.c点溶液中:c(Na+)<10c(HX)
C.b点坐标为(0,4.50)
D.溶液中水的电离程度:c<b<a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:aA(g)+bB(g)![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
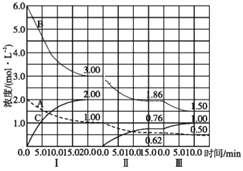
回答下列问题:
(1)反应的化学方程式中,a∶b∶c为___;
(2)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是___;
(3)由第一次平衡到第二次平衡,平衡移动的方向是___,采取的措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“环境就是民生,青山就是美丽,蓝天也是幸福。“拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)排放到大气中的氮的氧化物,会造成___污染。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氨废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以NH4+和NH3·H2O形式存在,为达到变废为宝回收利用的目的。可采取的方法是___。
②某团队设计处理流程如下:
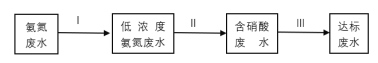
过程Ⅱ为硝化过程,在微生物的作用下实现NH4+→NO2-→NO3-的转化,在碱性条件下NH4+被氧气氧化成NO3-的总反应离子方程式为___。
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO2-→N2的转化,将lmol NO2-完全转化为N2,转移的电子数为___。
(3)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为____。
②某兴趣小组对取得的酸雨样品进行pH测定,随着的简的推移,得到以下数据(pH越小,酸性越强)。
时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
雨水pH变化的主要原因是___(用化学方程式表示)。
③某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___吨(假设生产过程中96%SO2转化为SO3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:

已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
③PbCl2、AgNO3的溶解度曲线如图所示:

(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com