
【题目】在化学课上围绕浓硫酸的化学性质进行如下实验探究,将适量的蔗糖放入烧杯中,加几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。请回答下列问题:
(1)生成的这种黑色物质(单质)是(填化学式)____________________。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的污染物之一,这种刺激性气味气体为(填化学式)_________,反应的化学方程式为________。
(3)根据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填字母) _______。
A.酸性 B.吸水性
C.脱水性 D.强氧化性
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液_______,说明这种气体有______性;将(2)中产生的有刺激性气味的气体通入氯水中,发生反应的化学方程式为_______。
(5)能否用澄清石灰水鉴别(2)中产生的两种气体 (填“能”或“不能”)________,若不能,请写出两种可以鉴别这两种气体的试剂:________________。
【答案】C SO2 C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O BCD 褪色 漂白 SO2+Cl2+2H2O =H2SO4+2HCl 不能 品红溶液、溴水或高锰酸钾溶液
2SO2↑+CO2↑+2H2O BCD 褪色 漂白 SO2+Cl2+2H2O =H2SO4+2HCl 不能 品红溶液、溴水或高锰酸钾溶液
【解析】
(1)浓硫酸具有脱水性,生成的黑色物质为蔗糖与浓硫酸后脱水形成碳单质,故答案为:C;
(2)浓硫酸具有强氧化性,蔗糖脱水形成的碳单质在脱水放出的热量作用下与浓硫酸反应生成二氧化硫、二氧化碳和水,具有刺激性气味的二氧化硫是大气的污染物之一,反应的化学方程式为C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O,故答案为:SO2;C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O,故答案为:SO2;C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O ;
2SO2↑+CO2↑+2H2O ;
(3)根据实验现象及(1) (2)的分析知,在蔗糖与浓硫酸的反应中,浓硫酸具有吸水性、脱水性和强氧化性,BCD正确,故答案为:BCD;
(4)将(2)中产生的有刺激性气味的气体二氧化硫通入品红溶液中,由于二氧化硫具有漂白性,品红溶液会褪色,二氧化硫具有还原性,能与氯气在水中反应生成硫酸和盐酸,反应的化学方程式为SO2+Cl2+2H2O= H2SO4+2HCl,故答案为:褪色;漂白;SO2+Cl2+2H2O= H2SO4+2HCl;
(5)(2)中产生的二氧化硫、二氧化碳通入澄清石灰水中,都能产生白色沉淀,现象相同,不能用澄清石灰水鉴别;二氧化硫具有漂白性可使品红溶液褪色、具有还原性可使溴水、高锰酸钾溶液褪色,二氧化碳不能使品红溶液、溴水、高锰酸钾溶液褪色,二氧化硫和二氧化碳可选用品红溶液、溴水、高锰酸钾溶液进行鉴别,故答案为:不能;品红溶液、溴水、高锰酸钾溶液。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定条件,向一密闭容器中充入一定量CO2气体,并加入足量铁粉,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
FeO(s)+CO(g),已知该反应在不同温度下的平衡常数如下:
T/℃ | 1200 | 1100 | 1000 | 900 | 800 |
K | 0.36 | 0.49 | 1.0 | 1.23 | 1.89 |
(1)该反应的化学平衡常数表达式为K=______。
(2)该反应为______(填“吸热”或“放热”)反应。
(3)能判断该反应是否达到化学平衡状态的依据是____。
A.容器中压强不变 B.混合气体中c(CO)不变
C.混合气体的平均相对分子质量不变 D.c(CO2)=c(CO)
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是_____(填序号)。
A.温度 B.铁粉的量(足量)
C.压强 D.CO的量
(5)在900℃下,该反应达到平衡时,CO2的物质的量浓度为2mol·L-1,则此时c(CO)=____ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图。其中X是一种强碱,G为正盐,通常条件下Z是无色液体,D的相对原子质量比C小16,各物质转化关系如图所示。下列说法正确的是( )
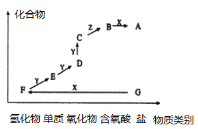
A.D气体一般用排空气法收集B.F和Y在一定条件下不能直接生成C
C.A的水溶液呈酸性D.E→D可用于检验D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,对于pH=11的氨水,下列判断正确的是
A. 该氨水的浓度为1.0×10-3mol·L-1
B. 加水稀释,溶液中所有离子的浓度均减小
C. 加水稀释,溶液中c(NH4+)/c(NH3·H2O)变大
D. 与pH=3的盐酸等体积混合,反应后溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.096 kg碳完全燃烧生成CO2气体可放出3147.9 kJ的热量,则下列热化学方程式正确的是( )
A. C(s)+O2(g)===CO2(g) ΔH=-393.49 kJ/mol
B. C(s)+O2(g)===CO2(g) ΔH=+393.49 kJ/mol
C. C+O2===CO2 ΔH=-393.49 kJ/mol
D. C(s)+![]() O2(g)===CO(g) ΔH=-393.49 kJ/mol
O2(g)===CO(g) ΔH=-393.49 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1000molL-1NaOH溶液滴定20mL0.1000molL-1H3PO4溶液,溶液的pH与所加NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.H3PO4的电离平衡常数Ka1约为10-2
B.当V(NaOH溶液)=40mL时,c(PO![]() )+c(OH-)=c(H+)+c(H2PO
)+c(OH-)=c(H+)+c(H2PO![]() )+2c(H3PO4)
)+2c(H3PO4)
C.当pH=7时,c(Na+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )
)
D.当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO![]() )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
![]()
A. 氢化物的稳定性:R<Q<T
B. T的单质是一种良好的半导体材料
C. Q、R的简单氢化物分子所含质子数、电子数与氖原子相同
D. T、W的最高价氧化物的水化物的酸性W强于T
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物应用非常广泛。下列有关说法正确的是( )
A.地下钢管常用牺牲阳极的阴极保护法,阳极材料可用铜
B.反应Cu2S+O2![]() 2Cu+SO2,每生成1molCu转移电子数为6.02×1023
2Cu+SO2,每生成1molCu转移电子数为6.02×1023
C.反应2Cu+CO2+H2O+O2=Cu2(OH)2CO3室温下能自发进行,该反应的ΔH<0
D.室温下,Ksp[Fe(OH)3]=4×10-38,pH=4的含Fe3+溶液中,c(Fe3+)≤4×10-8mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com