
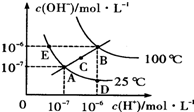
| A、图中五点KW间的关系B>C>A=D=E |
| B、若从A点到D点,可采用在水中加入少量酸的方法 |
| C、若从A点到C点,可用温度不变时在水中加入适量NH4Cl固体的方法 |
| D、若处在B点时,将pH=2的硫酸与pH=l2的KOH等体积混合后,溶液显碱性 |


科目:高中化学 来源: 题型:
| A、7.8 g Na2O2中含有的离子总数为0.4 |
| B、1 mol FeCl3制成胶体,所得胶体粒子数目为NA |
| C、pH=13的氢氧化钠溶液中所含Na+为0.1NA |
| D、5.6 g铁与足量的盐酸反应失去电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Na2A、NaHA两溶液中,离子种类不相同 |
| B、在溶质物质的量相等的Na2A、NaHA两溶液中有:2c(Na+)=3c(A2-)+3c(HA-)+3c(HA) |
| C、在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) |
| D、在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 |
| B、胶体与溶液的本质区别是能否出现丁达尔现象 |
| C、Mg(OH)2难溶于水,但可缓慢溶于浓的NH4Cl溶液 |
| D、油脂在酸性条件下可以水解,可用此反应可以制作肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
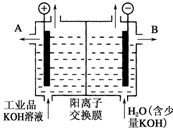 氢氧化钾是重要的工业产品.请回答:
氢氧化钾是重要的工业产品.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:H2SiO3>H2CO3 |
| B、热稳定性:HF>H2O>NH3 |
| C、沸点:HBr>HCl>HF |
| D、离子半径:Na+>F->Li+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com