
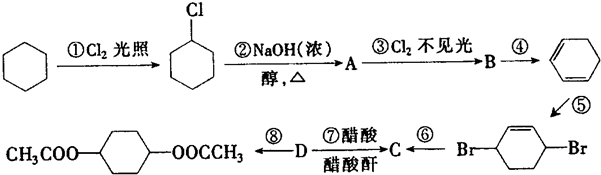
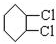
 ,C
,C .
.分析 环己烷和氯气发生取代反应生成 ,
, 在氢氧化钠的醇溶液、加热条件下发生消去反应生成A为:
在氢氧化钠的醇溶液、加热条件下发生消去反应生成A为: ,A和氯气反应生成B,B发生消去反应生成
,A和氯气反应生成B,B发生消去反应生成 ,所以B为
,所以B为 ,则A和氯气发生加成反应生成B,
,则A和氯气发生加成反应生成B, 和溴发生1,4-加成反应生成
和溴发生1,4-加成反应生成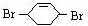 ,
,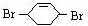 在氢氧化钠的水溶液、加热条件下发生取代反应生成C为
在氢氧化钠的水溶液、加热条件下发生取代反应生成C为 ,
, 与醋酸酐发生酯化反应生成D为
与醋酸酐发生酯化反应生成D为 ,D与氢气发生加成反应生成
,D与氢气发生加成反应生成 .
.
解答 解:环己烷和氯气发生取代反应生成 ,
, 在氢氧化钠的醇溶液、加热条件下发生消去反应生成A为:
在氢氧化钠的醇溶液、加热条件下发生消去反应生成A为: ,A和氯气反应生成B,B发生消去反应生成
,A和氯气反应生成B,B发生消去反应生成 ,所以B为
,所以B为 ,则A和氯气发生加成反应生成B,
,则A和氯气发生加成反应生成B, 和溴发生1,4-加成反应生成
和溴发生1,4-加成反应生成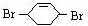 ,
,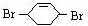 在氢氧化钠的水溶液、加热条件下发生取代反应生成C为
在氢氧化钠的水溶液、加热条件下发生取代反应生成C为 ,
, 与醋酸酐发生酯化反应生成D为
与醋酸酐发生酯化反应生成D为 ,D与氢气发生加成反应生成
,D与氢气发生加成反应生成 .
.
(1)根据上面的分析可知,反应①、⑥、⑦属于取代反应,故答案为:⑥、⑦;
(2)由上述分析可知,其中属于消去反应的是:②④,故答案为:②④;
(3)B的结构简式为 ,C的结构简式为:
,C的结构简式为: ,
,
故答案为: ;
; ;
;
(4)反应④发生卤代烃的消去反应,所用试剂和条件是:氢氧化钠醇溶液、加热,
故答案为:氢氧化钠醇溶液、加热.
点评 本题考查有机物的合成,根据有机物的结构进行推断,熟练掌握官能团的性质与转化,试题培养了学生的分析、理解能力及逻辑推理能力.


 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 3 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏自来水可得到蒸馏水 | B. | 酸溶法除去Al2O3的Fe2O3 | ||
| C. | 过滤法除去乙酸中的乙醇 | D. | 碱溶法除去Al2O3中的SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na2S去除废水中的Hg2+,Hg2++S2-═HgS↓ | |
| B. | 向Fe(NO3)2溶液中滴人稀硫酸.溶液由浅绿色变为黄色3Fe2++4H++NO3-=3Fe2++NO↑+2H2O | |
| C. | 用醋酸、淀粉碘化钾试纸检测加碘食盐中是否有KIO3,IO3-+6I-+6H+=3I2+3H2O | |
| D. | 消毒液的主要成分为NaClO溶液,与洁厨灵混用.产生有毐Cl2,2H+++Cl-+ClO-=Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维--Si | B. | 熟石灰--CaO | ||
| C. | 水煤气--CO、H2 | D. | 绿矾--Fe2(SO4)3•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
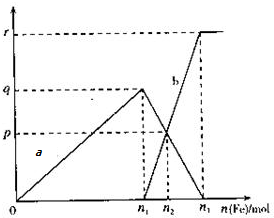 在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:
在11.2mol/L的稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入的铁粉的物质的量的关系如图所示(其中纵坐标为氧化产物的物质的量,横坐标为加入铁粉的物质的量),请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.8 mol•L-1•s-1 | B. | v(A2)=0.4 mol•L-1•s-1 | ||
| C. | v(C)=0.6 mol•L-1•s-1 | D. | v(B2)=0.42 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量日报的主要目的是树立人们环保意识,同时也让人们知道了二氧化硫、二氧化氮和可吸入颗粒物是大气主要污染物 | |
| B. | 酸雨是指pH小于7的雨水 | |
| C. | 为了减少二氧化硫和二氧化氮的排放,工业废气排放到大气之前必须进行回收处理 | |
| D. | 食品厂产生的含丰富氮、磷营养素的废水不可以长期排向水库 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com