
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为: .
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)⇌CH3OH(g)△H=﹣90.8kJ•mol﹣1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=﹣23.5kJ•mol﹣1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=﹣41.3kJ•mol﹣1
写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式 .
(3)一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是 .
a.高温高压 b.低温低压 c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚 f.加入催化剂
(4)已知反应②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L﹣1) | 0.44 | 0.6 | 0.6 |
比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”),若上述情况达到平衡,此时c(CH3OH)= .
| 煤的干馏和综合利用;热化学方程式;化学平衡的影响因素. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程; (2)利用盖斯定律计算; (3)反应达到平衡,要提高CO的转化率化学平衡正向进行; (4)依据浓度商和平衡常数比较分析反应进行的方向;依据平衡常数和化学平衡三段式列式计算得到. |
| 解答: | 解:(1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程:C+H2O (2)由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=﹣90.8kJ/mol×2﹣23.5kJ/mol﹣41.3kJ/mol=﹣246.4kJ/mol,反应的热化学方程式3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=﹣246.4kJ•mol﹣1, 故答案为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=﹣246.4kJ•mol﹣1; (3)a.由于反应放热,升高温度平衡向逆反应方向移动; b.压强减小,平衡向逆反应方向移动; c.减少CO2的浓度平衡向正反应反应移动; d.增加CO的浓度,CO的转化率反而减小; e.分离出二甲醚平衡向正反应反应移动; f.加入催化剂不影响平衡移动; 故答案为:c、e; (4)表中数据分析计算Q= 甲醇起始量浓度为0.44+1.2=1.64mol/L.设转化的甲醇浓度为x 2CH3OH(g)⇌CH3OCH3(g)+H2O(g) 起始量( mol/L)1.64 0 0 变化量(mol/L) x 0.5x 0.5x 平衡量(mol/L) 1.64﹣x 0.5x 0.5x K= 计算得到x=1.6mol/L 若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol/L. 故答案为:>;0.04 mol/L. |
| 点评: | 本题考查热化学方程式和盖斯定律的分析应用,化学平衡的有关知识和化学计算,本题难度不大,做题时注意平衡三段式的应用. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(1)如图所示的是干冰的晶胞结构。观察此图,发现干冰的晶胞呈________体。在干冰晶体中CO2分子之间通过________结合为晶体。
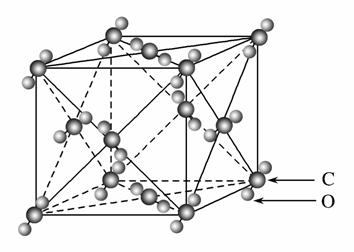
(2)试判断:①CO2 ②CS2 ③SiO2晶体的沸点由高到低排列的顺序是________>________>________(填写相应物质的编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
由乙烯和其他无机原料合成环状化合物,其合成过程如图(水及其他无机产物均已省略)。
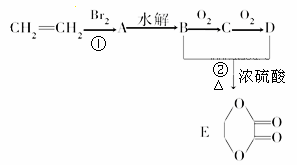
请分析后回答下列问题:
(1)写出下列反应的反应类型:① ,② 。
(2)D物质中的官能团名称为 。
(3)物质X与A互为同分异构体,则X的结构简式为 。
(4)A→B的反应条件为 。
(5)写出下列转化的化学方程式:C→D 。B+D→E 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒压下,向密闭容器中充入4mol A和2mol B,发生如下反应:2A(g)+B(g)⇌2C(g)△H<0.2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
|
| A. | 若反应开始时容器体积为2L,则v(C)=0.4mol/(L•min) |
|
| B. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
|
| C. | 若2min后,向容器中再投入等物质的量A、C,B的转化率不变 |
|
| D. | 若该反应在恒温恒容下进行,放出热量将增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在﹣50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)⇌N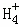 +N
+N ,N
,N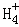 的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
|
| A. | 在液氨中加入NaNH2,可使液氨的离子积变大 |
|
| B. | 在液氨中加入NH4Cl,液氨的离子积不变 |
|
| C. | 此温度下液氨的离子积K为1×10﹣30 |
|
| D. | 在液氨中加入金属钠可能有NaNH2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列实验方法中,不能证明醋酸是弱酸的是( )
A.25 ℃时,醋酸钠溶液呈碱性
B.25 ℃时,0.1mol·L-1的醋酸的pH约为3
C.25 ℃时,等体积的盐酸和醋酸,前者比后者的导电能力强
D.25 ℃时,将pH=3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水多
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子中所有原子都满足最外层8电子结构的是( )
①光气(COCl2) ②六氟化硫 ③HCHO ④三氟化硼
⑤PCl3 ⑥PCl5 ⑦NO2 ⑧二氟化氙 ⑨N2 ⑩CH4
A.⑥⑦⑨ B.①⑤⑨
C.①④⑤⑦ D.①④⑤⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生 素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:

该工艺的主要流程如下:
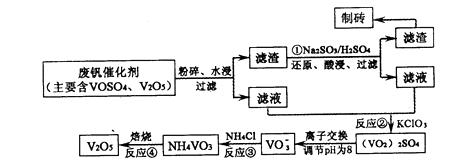
请回答下列问题。
(1)工业上由V2O5冶炼金属钒常用铝热剂法,用化学方程式表示为 。
(2)反应①的目的是 。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,写出该步发生反应的离子方程式: 。
(4)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量:VO2++H2C2O4+H+→VO2++CO2+X。X为 (写化学式)。
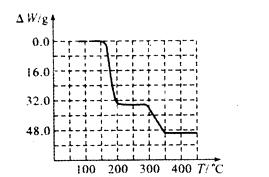
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化 的曲线如上图所示。则NH4VO3在分解过程中 (填序号)。
A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com