
| 实验编号 | 烧杯中所加的试剂及其用量(mL) | 加入少 量固体 | 溶液褪色 时间(s) | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 1 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| 2 | 15.0 | 15.0 | 10.0 | 无 | 3.6 | |
| 3 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| 4 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
| A、实验3、4说明K+对该反应有催化作用 |
| B、实验2中x=10 |
| C、实验1、2说明反应速率只与KMnO4浓度有关 |
| D、实验1、4可推出实验1中反应速率变化:起初较小,后明显变大,又逐渐变小 |


科目:高中化学 来源: 题型:
| A、Na2CO3溶液与稀盐酸 |
| B、CuSO4溶液与BaCl2溶液 |
| C、稀H2SO4与NaCl溶液 |
| D、稀HNO3与Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取1mLA溶液于一试管中,加入约2mL的CCl4,充分振荡后静置. | |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
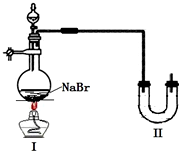 某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
某学校同学进行乙醇的化学性质实验探究学习,以下为他们的学习过程.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 镁的质量 | 镁的规格 | 盐酸的体积 | 盐酸的浓度 | 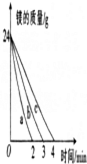 |
| ① | 24g | 镁条 | 500mL | 6mol?L-1 | |
| ② | 24g | 24g镁条 剪成100段 | 500mL | 6mol?L-1 | |
| ③ | 24g | 镁粉 | 500mL | 6mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
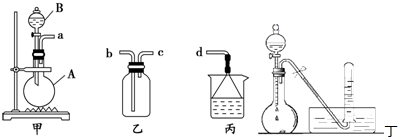
查看答案和解析>>
科目:高中化学 来源: 题型:
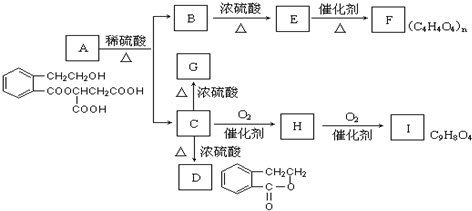
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com