
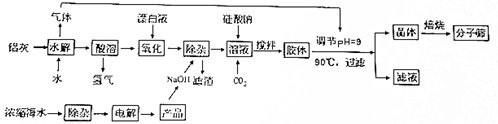
分析 铝灰主要成分为Al、Al2O3、AlN、FeO等加入水发生反应,AlN和水反应生成氢氧化铝和氨气,加入盐酸酸溶后,生成氯化铝溶液和氯化亚铁溶液,同时铝与盐酸会放出氢气,加入漂白液氧化亚铁离子为铁离子,浓缩海水,除杂后电解,得氢氧化钠溶液,在加入漂白液后的溶液中加入氢氧化钠,得到氢氧化铁沉淀和偏铝酸钠溶液,过滤后,在得到的滤液中加入硅酸钠和二氧化碳,搅拌得胶体,在溶液中通入前面水解产生的氨气,调节pH值到9,过滤得到晶体和滤液,将得到的晶体焙烧后得NaAlSiO4•nH2O,滤液中主要含有氯化铵;
(1)分离正丁烷和异丁烷,应选用分子筛的型号介于4.65A~5.6A之间;
(2)铝灰中的AlN和水发生水解反应生成氢氧化铝沉淀和氨气,加热可以促进氮化铝水解生成氨气;
(3)在酸溶时有氢气产生,电解盐酸水也有氢气和氯气产生,氯气和氢气可反应生成氯化氢,溶于水得盐酸,可用于酸溶,降低生产成本;
(4)氧化时主要是次氯酸根离子氧化亚铁离子生成铁离子;
(5)根据上面的分析可知该工艺中滤渣的成分;
(6)“胶体”调节pH后过滤所得“晶体”需洗涤,通过检验晶体表面 是否有氯离子可判断洗涤是否干净.
解答 解:(1)分离正丁烷和异丁烷,应选用分子筛的型号介于4.65A~5.6A之间,则应选用5A型,故答案为:5A;
(2)铝灰中的AlN和水发生水解反应生成氢氧化铝沉淀和氨气,反应的化学方程式为:AlN+3H2O$\frac{\underline{\;90℃\;}}{\;}$Al(OH)3+NH3↑,加热可以促进氮化铝水解生成氨气,降低NH3在水中的溶解度,促使NH3逸出;
故答案为:AlN+3H2O$\frac{\underline{\;90℃\;}}{\;}$Al(OH)3+NH3↑;降低NH3在水中的溶解度,促使NH3逸出;
(3)在酸溶时有氢气产生,电解盐酸水也有氢气和氯气产生,氯气和氢气可反应生成氯化氢,溶于水得盐酸,可用于酸溶,即反应中的副产物可生产得盐酸,降低生产成本,所以酸溶时用盐酸,
故答案为:盐酸;反应中的副产物可生产得盐酸,降低生产成本;
(4)氧化时主要是次氯酸根离子氧化亚铁离子生成铁离子,反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,
故答案为:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O;
(5)根据上面的分析可知该工艺中滤渣的成分为Fe(OH)3,
故答案为:Fe(OH)3;
(6)“胶体”调节pH后过滤所得“晶体”需洗涤,通过检验晶体表面是否有氯离子可判断洗涤是否干净,其操作为取最后一次洗涤滤液,滴入硝酸酸化的硝酸银,若无白色沉淀出现,则说明洗涤干净,否则就没有洗涤干净,
故答案为:取最后一次洗涤滤液,滴入硝酸酸化的硝酸银,若无白色沉淀出现,则说明洗涤干净,否则就没有洗涤干净.
点评 本题考查较为综合,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型和高频考点,注意把握题给信息,把握信息抽去能力的培养,从质量守恒的角度计算分子筛的化学式,难度中等.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大H2O2的浓度 | B. | 加入少量MnO2粉末 | ||
| C. | 加入几滴FeCl3溶液 | D. | 把盛有H2O2溶液的试管放在冰水里 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂为KMnO4 | |
| B. | 发生还原反应的是H2C2O4 | |
| C. | 该离子方程式右侧方框内的产物是H2O | |
| D. | 6mol H+参加反应时,电子转移10mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2(g)?N2O4(g),升温时体系颜色加深说明正反应为吸热反应 | |
| B. | N2(g)+3H2(g)?2NH3(g),若升温时NH3的浓度减小,则平衡常数K增大 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g),升温时CO的转化率增大,说明正反应为吸热反应 | |
| D. | 反应2HI(g)?H2(g)+I2(g)达到平衡后,增大HI的物质的量,平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | 可用超纯硅制造的单晶硅来制造计算机的芯片 | |
| C. | 实验室用二氧化锰和浓盐酸共热制取少量氯气 | |
| D. | 氢氧化钠溶液要盛放在磨口玻璃塞的试剂瓶里 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com