
在一定条件下,单质B、C、D、E都能与A单质发生化合反应,转化关系如图所示。已知:①G是黑色晶体,能吸附B单质;②H能与氢氧化钠溶液或盐酸反应;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;④I是绿色植物光合作用的原料,温室中常用它作肥料。根据上述信息,回答下列问题: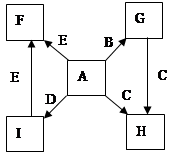

(1)I的电子式为 ,G的俗名是 。
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为 。
(3)根据E和A反应的能量变化图像写出热化学方程式: 。
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离
子方程式:
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数 。
(1) (1分), 磁性氧化铁(1分)
(1分), 磁性氧化铁(1分)
(2) Al-3e-+4OH-= AlO2-+2H2O (2分)
(3)2Mg(s)+O2(g)=2MgO(s) △H = -10QkJ/mol(2分)
(4)3AlO2-+Al3++6H2O = 4Al(OH)3↓(2分)
(5) (2分)
(2分)
解析试题分析:根据题意和转化关系图分析:①G是黑色晶体,能吸附B单质,则G为Fe3O4,B为Fe,A为O2,②H能与氢氧化钠溶液或盐酸反应;H为两性氧化物氧化铝,C为铝;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;为铝热反应的引发操作,E为镁,F为氧化镁;④I是绿色植物光合作用的原料,I为二氧化碳,D为碳;(1)I为CO2,电子式为 ,G为四氧化三铁,俗名是磁性氧化铁;(2)以铝和镁为电极在NaOH溶液中构成原电池,铝与NaOH溶液反应,作原电池的负极,该原电池的负极反应式为Al-3e-+4OH-= AlO2-+2H2O;(3)根据能量变化图像可写出镁和氧气反应的热化学方程式:2Mg(s)+O2(g)=2MgO(s) △H = -10QkJ/mol;(4)两种常见含铝元素的盐,一种pH>7,为偏铝酸盐,另一种pH<7,为铝盐,两种溶液混合时发生反应的离子方程式为3AlO2-+Al3++6H2O = 4Al(OH)3↓;(5)铁在高温下和水蒸气反应的化学方程式及电子转移方向和总数为
,G为四氧化三铁,俗名是磁性氧化铁;(2)以铝和镁为电极在NaOH溶液中构成原电池,铝与NaOH溶液反应,作原电池的负极,该原电池的负极反应式为Al-3e-+4OH-= AlO2-+2H2O;(3)根据能量变化图像可写出镁和氧气反应的热化学方程式:2Mg(s)+O2(g)=2MgO(s) △H = -10QkJ/mol;(4)两种常见含铝元素的盐,一种pH>7,为偏铝酸盐,另一种pH<7,为铝盐,两种溶液混合时发生反应的离子方程式为3AlO2-+Al3++6H2O = 4Al(OH)3↓;(5)铁在高温下和水蒸气反应的化学方程式及电子转移方向和总数为 。
。
考点:考查无机框图推断及相关物质的性质。


科目:高中化学 来源: 题型:填空题
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。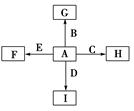
已知:
①单质中只有A为金属,在大气层高空释放的蒸气呈现明亮的橙黄色云雾,科学家由此可确定火箭在空中的位置;B、C、D为气体,E为固体;C、E为有色物质。
②B与D可以生成化合物J,A与J反应生成D和另一种化合物K,C与K反应的产物含漂白液的有效成分,F、G、I的水溶液呈碱性。
回答问题:
(1)化合物K的电子式为________。
(2)F的水溶液呈碱性的原因(用离子方程式表示)_________________________________,写出I与J反应的化学反应方程式__________________________________________。
(3)实验室制备C的离子反应方程式为_____________________________。
(4)D在C中燃烧观察到的现象是_________________________________。
(5)可利用B与D生成化合物J的反应制成燃料电池,若1 g D在B中燃烧生成气态J时,放出120.9 kJ的热量,已知1 mol J 在汽化时吸热44.0 kJ,写出表示D的燃烧热的热化学方程式_____________________________________________________,利用K作电解质溶液,写出该燃料电池的负极的电极反应方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀。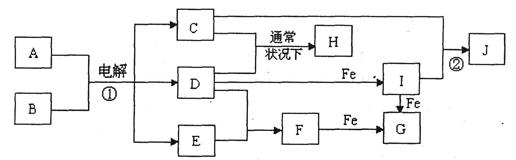
(1)H的化学式为 。
(2)F的电子式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图中,A、B、C、D、E是单质G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知: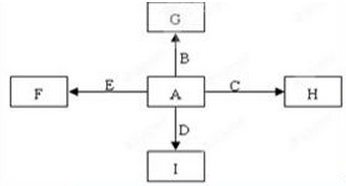
①若G为红棕色固体,反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中E元素的质量分数为60%。回答问题:
2F+D,F中E元素的质量分数为60%。回答问题:
(1)①中反应的化学方程式为______________________________;
(2)3.2 g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量为
(3)C与过量NaOH溶液反应的离子方程式为______________________,
(4)E在I中燃烧观察到的现象是___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(某些物质已经略去),其中A、B、D在常温下均为无色无刺激性气味的气体,C是使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。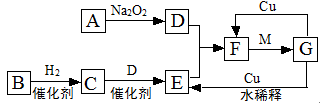
(1)物质G的化学式: 。
(2)物质B的电子式: 。
(3)写出C→E的化学方程式: ;
(4)G→F的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y是短周期同主族元素,Z是过渡元素,化合物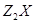 、
、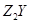 可发生如下转化。
可发生如下转化。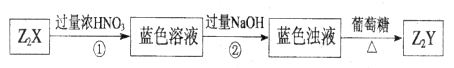
(1)X的元素符号为_________,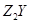 的化学式为_________。
的化学式为_________。
(2)蓝色溶液中含有的阴离子是_______________。
(3)过程②中发生反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题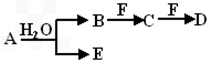
(1)若常温下A为有色气体
①若F是一种金属单质,请写出B和适量F反应生成C与气体E的离子方程式:_________________ _____________。
②若C为直线型分子,E具有漂白性,物质F焰色反应呈黄色,请写出工业上制备物质F的化学反应方程式:_______ ____________;__________ _____。
(2)若A为淡黄色固体,则A物质的电子式为:_________________。
①若物质B和D的相对分子质量相等,物质C的大量排放往往会造成严重的环境问题即_____ _____;
②若物质A和D的相对分子质量相等,请用离子方程式表示物质F的水溶液呈酸性的原因_____ _____。
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的1/5,将B和D分别溶于水,所得溶液按恰当比例混合,可得一不含金属元素的盐溶液,请写出A的化学式________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲可作发酵粉,乙是一种常用的化肥。B、D常温下是气体。请回答下列问题:
(1)甲的俗名是____________。
(2)D的水溶液滴入酚酞试液后,溶液显红色,请用必要的文字加以解释并写出相关的离子方程式:___ _________。
(3)甲溶液中加入氯化铝溶液,可以观察到的现象为 试写出反应的离子方程式:____
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分:
| 族 周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com