
醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表:
反应 | 乙醇(mol) | 乙酸(mol) | 乙酸乙酯(mol) |
1 | 2 | 2 | 1.33 |
2 | 3 | 2 | 1.57 |
3 | 4 | 2 | x |
4 | 5 | 2 | 1.76 |
由表中数据推测,数值x的范围是________。
(2)现有25°C时,pH=3的醋酸。请回答以下问题:
①若向醋酸中加入少量醋酸钠固体,此时溶液中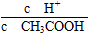 将________(填“增大”“减小”或“不变”);
将________(填“增大”“减小”或“不变”);
②若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH________7(填“>”“<”或“=”);
③若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是________。
(1)1.57<x<1.76 (2)①减小 ②>
③c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
【解析】(1)根据表中数据,增大乙醇的量,平衡一定正向移动,生成乙酸乙酯的量一定增大。(2)①CH3COOH CH3COO-+H+,外加CH3COONa,c(CH3COO-)增大,平衡逆向移动,c(CH3COOH)增大,c(H+)减小,则
CH3COO-+H+,外加CH3COONa,c(CH3COO-)增大,平衡逆向移动,c(CH3COOH)增大,c(H+)减小,则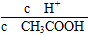 减小;②CH3COOH+NaOH=CH3COONa+H2O,二者完全反应后溶液中的溶质只有CH3COONa,CH3COONa可发生水【解析】
减小;②CH3COOH+NaOH=CH3COONa+H2O,二者完全反应后溶液中的溶质只有CH3COONa,CH3COONa可发生水【解析】
CH3COO-+H2O CH3COOH+OH-,c(OH-)>c(H+),溶液呈碱性;③CH3COOH是弱电解质,与NaOH反应后,CH3COOH过量,溶液呈酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
CH3COOH+OH-,c(OH-)>c(H+),溶液呈碱性;③CH3COOH是弱电解质,与NaOH反应后,CH3COOH过量,溶液呈酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2015届吉林省高二3月月考化学试卷(解析版) 题型:填空题
营养平衡、合理用药是保证人体健康和生活质量的重要途径。
①人体需要的营养素主要有糖类、 、蛋白质、无机盐、维生素和水。在氢、钠、铁这三种元素中,属于人体生命活动必需微量元素的是 。
②下列物质中,具有解热镇痛疗效的是 (填字母)。
a.氨基酸 b.阿斯匹林 c.青霉素
③有些药片常用淀粉作为黏合剂,淀粉进入人体后在人体内酶的催化作用下逐步水解,最终转化为 (填物质的名称)。维生素C能防治坏血病并具有还原性,验证维生素C有还原性可以使用淀粉溶液和 试剂共同完成。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.医用酒精的浓度通常为95%
B.单质硅是将太阳能转变为电能的常用材料
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题9有机化合物的获取与应用练习卷(解析版) 题型:选择题
浙江绍兴甜米酒有几千年的生产历史,其酒白如玉液,清香袭人。米酒饮用后既有酒味又有甜味,其中甜味来源是( )
A.淀粉→蔗糖→葡萄糖 B.淀粉→麦芽糖→葡萄糖
C.淀粉→麦芽糖→果糖 D.淀粉→蔗糖→果糖
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=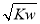 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题8溶液中的离子反应练习卷(解析版) 题型:选择题
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)  C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10 L的密闭容器中充入1 mol A和1 mol B,反应达平衡时测得容器中各物质的浓度为I。然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ。
| A | B | C |
Ⅰ | 0.050 mol·L-1 | 0.050 mol·L-1 | 0.050 mol·L-1 |
Ⅱ | 0.070 mol·L-1 | 0.070 mol·L-1 | 0.098 mol·L-1 |
Ⅲ | 0.060 mol·L-1 | 0.060 mol·L-1 | 0.040 mol·L-1 |
Ⅳ | 0.080 mol·L-1 | 0.080 mol·L-1 | 0.12 mol·L-1 |
针对上述系列试验,下列结论中错误的是( )
A.由Ⅰ中数据可计算出该温度下反应的平衡常数K=20 mol-1·L
B.Ⅱ可能是通过增大C的浓度实现的
C.若Ⅲ只是升高温度,则与I比较,可以判断出正反应一定是放热反应
D.第Ⅳ组实验数据的得出,通过压缩容器的体积就可以实现
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g)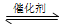 CO(g)+Cl2(g) ΔH<0,下列有关说法不正确的是( )
CO(g)+Cl2(g) ΔH<0,下列有关说法不正确的是( )
A.在一定条件下,使用催化剂能加快反应速率
B.当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C.单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:选择题
短周期元素A、B、C的原子序数依次增大。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是( )
A.原子半径:A<B<C
B.A单质的氧化性小于C单质
C.B的硫酸盐溶液pH<7
D.B元素单质可溶于酸但不溶于碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com