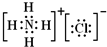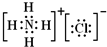(2009?南平二模)A、B、C、D为四种短周期元素,A、B、D的原子序数和原子半径均依次增大,B、D同主族且能组成一种能形成“酸雨”的化合物.A、B可以形成A
2B和A
2B
2的两种通常情况下呈液态的共价化合物;B、C形成的两种离子化合物溶于水,所得的溶液均呈强碱性;C的单质常温下可与A
2B剧烈反应.试回答下列问题:
(1)B、C两元素以微粒个数比1:1形成的化合物X中,阴、阳离子个数比为
1:2
1:2
.
(2)在A
2B
2作用下,铜与稀硫酸制硫酸铜的化学反应的化学方程为:
Cu+H2SO4+H2O2=CuSO4+2H2O
Cu+H2SO4+H2O2=CuSO4+2H2O
.
(3)表示形成DB
2型“酸雨”的化学反应方程式有多个,请你选择一个合适的反应,写出这个反应的平衡常数表达式K=
.
(4)已知常温下 17gA、D两元素组成的化合物与足量的DB
2完全反应时放出热量为a kJ,则该反应的热化学方程式为
2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H=-4akJ/mol
2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H=-4akJ/mol
.
(5)已知 25℃时,Ksp(CaCO
3)=1×10
-9.Ksp(CaSO
4)=9×10
-6.长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率.水垢中含有的CaSO
4,可先用Na
2CO
3溶液处理,使之转化为疏松、易溶于酸的CaCO
3,而后用酸除去.
①CaSO
4转化为CaCO
3的离子方程式为
CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq)
CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq)
;
②请分析CaSO
4转化为CaCO
3的原理
加入Na2CO3溶液后,CO32-与Ca2+结合,转化为Ksp更小的CaCO3沉淀,使CaSO4的沉淀溶解平衡向溶解方向移动
加入Na2CO3溶液后,CO32-与Ca2+结合,转化为Ksp更小的CaCO3沉淀,使CaSO4的沉淀溶解平衡向溶解方向移动
.

![]() CuSO4 + SO2↑+ 2H2O反应中,
CuSO4 + SO2↑+ 2H2O反应中, ![]() CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O (2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
(2008?海南)如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.