
����Ŀ���������Һ����������ϢϢ��أ���ش���������
��1��ij�¶��£�Kw=1��10��12�� molL��1��2 �� �������¶Ȳ��䣬��ˮ�е���ϡ����ǡ��ʹ��Һ��c��H+��/c��OH����=1��1010 �� ���ʱˮ�������c��H+��=molL��1 ��
��2������������Һ��pH=3��HA��ҺV1 mL��pH=11��NaOH��ҺV2 mL��϶��ã�������˵����ȷ���� ��
A.����Ϻ���Һ�����ԣ���c��H+��+c��OH����=2��10��7mol/L
B.��V1=V2 �� ��Ϻ���Һ��pHһ������7
C.����Ϻ���Һ�����ԣ���V1һ������V2
D.����Ϻ���Һ�ʼ��ԣ���V1һ��С��V2
��3�����������У������������ᣨ�ף�Ka=1.8��10��5 mol/L����һ�����ᣨ�ң�Ka=1.4��10��3 mol/L����ˮ�еĵ������Ũ�ȹ�ϵ���� 
��4��������ʵ���У���֤���������Ա��������������� ��
A.���������pH=4������ʹ���ϡ�ͳ�pH=5����Һ�������������ˮ���Ķ���
B.����������pH������ʹ����зֱ����ͬ������Ӧ���ι��壬����Һ��pH���ޱ仯
C.����������Ũ�ȵ�����ʹ���ֱ��������п�ۣ������������������
D.�õ��������Ũ�ȵ�����ʹ�����������ʵ�飬���ݵ��ݵ������̶ȣ�
���𰸡�
��1��10��11
��2��AD
��3��B
��4��ABD
���������⣺��1��ij�¶��£�Kw=1��10��12�� molL��1��2 �� ���¶���ˮ�м���ϡ�������Һ�д���c��H+��/c��OH����=1��1010 �� ����Һ��c��H+��=0.1mol/L������Һ��ˮ�������c��OH����= ![]() mol/L=10��11 mol/L������Һ��ˮ�������c��H+��������Һ��c��OH����=10��11 mol/L��
mol/L=10��11 mol/L������Һ��ˮ�������c��H+��������Һ��c��OH����=10��11 mol/L��
���Դ��ǣ�1��10��11����2��pH=3��HA��Һ�У�c��HA����0.001mol/L��pH=11��NaOH��Һ��c��NaOH��=0.001mol/L��
A������ҺM�����ԣ���c��H+��=c��OH����=1��10��7molL��1 �� ��c��H+��+c��OH����=2��10��7molL��1 �� ��A��ȷ��
B����V1=V2 �� ����HA��ǿ��δ֪����Ӧ����Һ������Բ���ȷ������ҺM��pH��һ������7����B����
C����HAΪ���ᣬ�������ϣ���ҺҲ���ܳ����ԣ���V1��һ������V2 �� ��C����
D����HAΪ���ᣬ�������ϳ����ԣ���ʼ��ԣ�V1һ��С��V2 �� ��HAΪǿ�ᣬ��Ӧ��ʼ��ԣ���V1һ��С��V2 �� ��D��ȷ��
��ѡ��AD����3�������ᣨ�ס�Ka=1.8��10��5����һ�����ᣨ�ҡ�Ka=1.4��10��3����֪�������KaС�����������������
��ͼ��֪��������ΪŨ�ȣ�������Ϊ����ȣ����Ũ��ʱ����ǿ�ĵ���ȴ��ҵ��������Ϸ������ų�A��C��
�����Ũ��Խ��������ԽС�������ס��Ҿ���Ũ�ȵ�������½������ų�D����Ȼֻ��B���ϣ�
��ѡB����4��A�����������pH=4������ʹ���ϡ�ͳ�pH=5����Һ�������������ˮ���Ķ��٣���������ˮ���������ᣬ˵�������д��ڵ���ƽ�⣬���������С�����ᣬ��Aѡ��
B������������pH������ʹ����зֱ����ͬ������Ӧ���ι��壬����Һ��pH���ޱ仯�����������ƴ�����뵼������ҺpH������֤����������С�����ᣬ��Bѡ��
C������������Ũ�ȵ�����ʹ���ֱ��������п�ۣ����������������������������������������ʵ��������ȣ�������ǿ���أ����Բ���֤����������С�����ᣬ��C��ѡ��
D���õ��������Ũ�ȵ�����ʹ�����������ʵ�飬���ݵ��ݵ������̶�ȷ����Һ������Ũ�ȣ��Ӷ�ȷ������ǿ������Dѡ��
��ѡABD��


 �㽭��У��ʦ���ϵ�д�
�㽭��У��ʦ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1�������½�NaOH��Һ��һԪ����HA��Һ��Ϻ�
�ش��������⣺
������PH=3��HA��Һ��PH=11��NaOH��Һ�������Ϻ���Һ��PHֵ7���������=��
������Ϻ���ҺPHֵ����7�����Ϻ���Һ�и�����Ũ�ȴ�С����Ϊ ��
��2����֪������Ksp[Al��OH��3]=3��10��34��Ksp[Fe��OH��3]=4��10��38��25����Ũ�Ⱦ�Ϊ0.1mol/L��AlCl3��FeCl3�����Һ����μ��백ˮ��
��д���������ɳ��������ӷ���ʽ �� ����ҺPH=10ʱ��C��Al3+��=mol/L
��3��1909�껯ѧ�ҹ�����ʵ�����״κϳ��˰�������Ӧ�ý϶࣬�ݴ˻ش��������⣺�ϳɰ���Ӧ�Ļ�ѧ����ʽΪN2��g��+3H2��g��2NH3��g����
��д���÷�Ӧ��ƽ�ⳣ������ʽ��K= ��
����һ�������µ�2L�ܱ������н���ʵ�飬�������������
���� | N2 | H2 | NH3 |
��ʼ��mol�� | 2 | 7 | 0 |
10s��mol�� | 1.6 | ||
ƽ�⣨mol�� | 2 |
ƽ��ʱ��N2��ת����Ϊ ��
����һ���¶ȣ�һ��������ܱ������н��кϳɰ���ʵ�飬���в������жϷ�Ӧ�ﵽƽ��״̬��Ϊ ��
A���ܶȱ��ֲ���
B��ƽ�����������ֲ���
C������������ʵ������ֲ���
D����λʱ����ÿ����1molN2��ͬʱ����2mol����
������β���к��н϶��NO2��NO�������ŷſ��γɹ⻯ѧ����������NH3�ɽ����ȥ��ͬʱ�õ�������Ⱦ���������ʣ���д��NH3��NO2��Ӧ�Ļ�ѧ��ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ӻ������������ȷ���ǣ�������
A. ���ӻ������ж��������Ӽ�
B. ���ӻ������е�������ֻ���ǽ�������
C. ���ӻ�����һ�����Ե���
D. ����ˮ���Ե���Ļ�����һ�������ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ѿ��г���������������ΪʳƷ���Ӽ���Ϊ���ij���Ѿ���Ʒ���������εĺ�����ͨ���Ծ�����SO2�����ƣ���ij�о�С�����������ʵ�飨��֪��ԭ�ԣ�SO32����I����Cl������ ![]()
����˵������ȷ���ǣ� ��
A.���Ѿ��м��������ε���ҪĿ���Ƿ�ֹ�������������������εĻ�ԭ��
B.ͨ��N2����е�Ŀ����Ϊ�˽��������������Һ��ȫ���ϳ�
C.���Լ�Aѡ����ˮ�����Լ�B��ѡ��NaOH��Һ
D.���Լ�Aѡ���Һ���������պ���ҺΪ���ԣ����Լ�B��ѡ��I2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥFeCl3��Һ�л��е�����FeCl2 �� ���������Һ��ͨ��������������������·�Ӧ��2FeCl2+Cl2�T2FeCl3 �� ���ڸ÷�Ӧ˵����ȷ���ǣ� ��
A.����������ԭ��Ӧ
B.���ڸ��ֽⷴӦ
C.Cl2����ԭ��
D.Fe2+����ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2010�꣬�й��״�Ӧ����Ȳ������ͭƬ����ϳ���ʯīȲ��Ĥ����ϳ�ʾ��ͼ��ͼ��ʾ����������ĵ��ӽṹ�������㷺Ӧ���ڵ��Ӳ�����������˵������ȷ���ǣ� �� 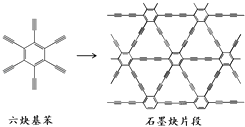
A.��Ȳ�����Ļ�ѧʽΪC18H6
B.��Ȳ������ʯīȲ������ƽ���ͽṹ
C.��Ȳ������ʯīȲ���ɷ����ӳɷ�Ӧ
D.��Ȳ�����ϳ�ʯīȲ���ڼӾ۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������оٵ���ij���������ɺ����ʣ���˵�������ʿ϶����л�����ǣ� ��
A.����̼��������Ԫ�����
B.����̼���⡢������Ԫ�����
C.��������ȼ��ֻ���ɶ�����̼
D.�۵�Ͷ���������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȡ���ʹҩ�ﲼ��ҵ����ֺϳ�·�����£� 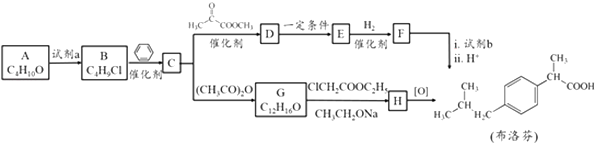
��֪��
��R������ ![]()
��R������ 
��R��R�䡢R��Ϊ��������ԭ�ӣ� 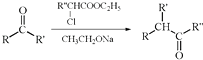
��1��AΪ������˴Ź����������ĸ����շ壮A�Ľṹ��ʽ�� ��
��2��A���Լ�a��Ӧ����B�ķ�Ӧ������ ��
��3����B����C�Ļ�ѧ����ʽ�� ��
��4��D��E����Է����������18����D����E�Ļ�ѧ��Ӧ����ʽ�� ��
��5��G�Ľṹ��ʽ�� �� H�ĺ��������ŵ������� ��
��6��������ж���ͬ���칹�壬д������������������������ͬ���칹��Ľṹ��ʽ ��
a���Ȼ��뱽��ֱ������ b��������������ȡ�������ұ����ϵ�һ�ȴ��������֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ��������۵�674�桢�е�1023�棻���Ȼ�����300��������������������ˮ������ǿ�ҵ���ˮ�ԣ���500���������Ȼ��������������ܷ������ַ�Ӧ����Ӧ֮һΪ��12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ij�о�С��ѡ������װ�ã��г�װ��ʡ�ԣ�װ�ÿ��ظ�ѡ�ã����з�Ӧ��̽�����ش��������⣺
2Fe2O3+8FeCl3 �� ij�о�С��ѡ������װ�ã��г�װ��ʡ�ԣ�װ�ÿ��ظ�ѡ�ã����з�Ӧ��̽�����ش��������⣺ 
��1��װ�õĺ�������˳��ΪA����D������Eװ��U�ι�������Ϊ�ֵ��ܵ�Ŀ���� ��
��2��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3����Ӧ���̷��֣�װ��B�г����ɺ���ɫ�����⣬���۲쵽����ɫ���壬���ɸ�����Ļ�ѧ����ʽΪ ��
��4����B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ������ ��
��5�����ʵ�飺 ������Eװ��U�ι���Ĺ�����֤Fe��OH��3����� ��
�ڲⶨװ��B�IJ�����������Ԫ�ص����������� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com