
【题目】设NA表示阿伏加德罗常数的值,下列说法错误的是( )
A. 1 mol Cl2与过量Fe粉反应生成FeCl3,转移2NA个电子
B. 4.7 g核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]()
![]() +
+![]() +3
+3![]() ,净产生的中子(
,净产生的中子(![]() )数为0.06NA
)数为0.06NA
C. 1 mol Zn与一定量浓硫酸恰好完全反应,则生成的气体分子数为NA
D. 在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成1 mol Cl2转移的电子数为1.75NA
【答案】B
【解析】
A.1 mol Cl2与过量Fe粉反应的产物是FeCl3,Cl2中的氯元素化合价由0价降低到-1价生成Cl-,1个Cl2过程中得2个电子,则1 mol Cl2过程中转移2 mol e-,故A正确;
B.核素![]() 发生裂变反应:
发生裂变反应:![]() +
+![]()
![]()
![]() +
+![]() +3
+3![]() ,净产生的中子(
,净产生的中子(![]() )数为3-1=2,
)数为3-1=2,
4.7 g核素![]() 的物质的量为0.02mol,则发生裂变时净产生的中子数为0.04NA,故B错误;
的物质的量为0.02mol,则发生裂变时净产生的中子数为0.04NA,故B错误;
C.1 mol Zn失去2 mol e-,故硫酸被还原为SO2和H2的物质的量之和为1 mol,则生成的气体分子数为NA ,故C正确;
D.反应KClO4+8HCl===KCl+4Cl2↑+4H2O中每生成4 mol Cl2就有1 mol KClO4参加反应,转移7 mol e-,所以每生成1 mol Cl2,转移的电子数为1.75NA,故D正确。答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图所示所得出的结论正确的是
A.图甲是一定温度下,处于恒容密闭容器、弱酸性环境下的铁钉发生腐蚀过程中体系压强的变化曲线,可推知初始阶段铁钉主要发生析氢腐蚀
B.图乙是平衡体系2NO2(g)![]() N2O4(g);ΔH=-56.9 kJ·mol-1改变某一条件后v(正)、v(逆)的变化情况,可推知t0时刻改变的条件是升高温度
N2O4(g);ΔH=-56.9 kJ·mol-1改变某一条件后v(正)、v(逆)的变化情况,可推知t0时刻改变的条件是升高温度
C.图丙是某温度下c(CH3COOH)+c(CH3COO-)=0.100 mol·L-1的醋酸与醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系,可推知该温度下pH=3的溶液中:Ka<10-4.75
D.图丁中虚线是2SO2+O2![]() 2SO3在催化剂存在下反应过程中能量的变化情况,可推知催化剂Ⅰ的催化效果更好
2SO3在催化剂存在下反应过程中能量的变化情况,可推知催化剂Ⅰ的催化效果更好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是

A. IO4﹣作氧化剂
B. 若有1 mol Mn2+参加反应转移5mol电子
C. 还原剂与氧化剂的物质的量之比为2:5
D. 配平后H+、Mn2+的化学计量数分别为4、2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲表示叶绿体的结构,图乙表示暗反应过程。请据图回答下列问题:

(l)叶绿体中的色素分布于图甲中的____ (填序号);四种色素能在滤纸条上分离,是因为____。
(2)叶绿体进行光合作用时,ATP的移动方向是从____到____(填序号),合成ATP所需的能量来自____。
(3)在光照强度、温度和CO2浓度三种环境因素中,能直接影响图乙所示过程的是 _________。若突然降低光照强度,则在短时间内叶绿体中C3和C5的含量变化分别是 _________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是

A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。
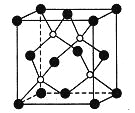
下列有关说法正确的是( )
A. 磷化硼晶体的熔点很低
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是:2NaCl(熔融)![]() 2Na+Cl2↑。回答下列有关单质钠的问题:
2Na+Cl2↑。回答下列有关单质钠的问题:
(1)下列各项中属于保存金属钠的正确方法是____。
A.放在棕色瓶中 B.放在细沙中C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图Ⅰ所示),请写出该反应的化学方程式____________,生成物的颜色为____。将该试管冷却后直立,滴加几滴水(如图Ⅱ所示),发生反应的化学方程式为____________,检验该反应产生的气体的方法是________________。

(3)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为____________(填化学式);过氧化钠与CO2反应的化学方程式__________________________。因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源。
(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种元素组成的矿物A,测定A的组成及制取化合物D的流程如图:
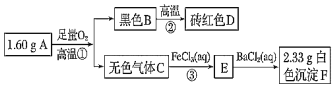
请回答:
(1)A的化学式为______
(2)写出③的离子方程式:______
(3)写出D溶于足量稀硝酸的化学方程式:______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com