
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_________________________________________________。
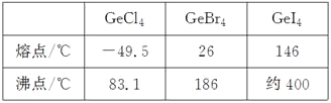
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
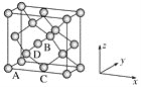
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为________。
,0)。则D原子的坐标参数为________。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
【答案】3d104s24p2 2 Ge原子半径大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键 GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强 O>Ge>Zn sp3 共价键 ![]()
![]()
【解析】
(1)Ge为32号元素,位于周期表中第四周期第IVA族,据此写出核外电子排布式并判断未成对电子数;
(2)Ge原子半径较大,pp轨道很难通过“肩并肩”的方式形成![]() 键;
键;
(3)Ge的卤化物都属于分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高;
(4)元素的非金属性越强,吸引电子的能力越强,电负性越大;
(5)Ge单晶具有金刚石型结构,Ge原子与周围的4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体;
(6)①D点与周围4个原子形成正四面体结构,且D点与A点的连线处于晶胞体对角线上,B、C分别为前、下两个面的面心,根据A、B、C的坐标参数确定D的坐标参数;
②根据均摊法计算晶胞中Ge原子的数目,结合NA计算出晶胞的质量,最后根据![]() 计算出密度。
计算出密度。
(1)Ge为32号元素,位于周期表中第四周期第IVA族,核外电子排布式为1s22s22p63s23p63d104s24p2即[Ar] 3d104s24p2;4p轨道中有2个未成对的电子;
(2)Ge原子半径较大,原子间形成的σ单键较长,pp轨道肩并肩重叠程度很小或几乎不能重叠,很难通过“肩并肩”的方式形成![]() 键;
键;
(3)根据表中数据,GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是:Ge的卤化物都属于分子晶体,分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强,熔沸点逐渐升高;
(4)元素的非金属性越强,吸引电子的能力越强,电负性越大,非金属性Zn<Ge<O,因此电负性O>Ge>Zn;
(5)Ge单晶具有金刚石型结构,Ge原子与周围的4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体,Ge原子之间以共价键相连接,杂化轨道数目为4,采取sp3杂化;
(6)①D点与周围4个原子形成正四面体结构,且D点与A点的连线处于晶胞体对角线上,B、C分别为前、下两个面的面心,原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0),则D点的坐标参数为(
,0),则D点的坐标参数为(![]() );
);
②根据均摊法可知晶胞中Ge原子的数目为4+8×![]() +6×
+6×![]() =8,晶胞的质量=
=8,晶胞的质量=![]() ,晶胞的体积V=(565.76 ×10-10cm)3,则密度/span>
,晶胞的体积V=(565.76 ×10-10cm)3,则密度/span>![]() =
=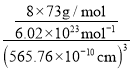 =
=![]() g·cm-3。
g·cm-3。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)有一瓶无色澄清溶液,其中可能含H+、Na+、Mg2+、Ba2+、Cl、SO42、CO32离子。现进行以下实验:
A、用pH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生。
①根据上述事实确定:该溶液中肯定存在的离子有_________________________;
肯定不存在的离子有___________________________。
②写出C中发生反应的离子方程式________________________________。
(2)①还原铁粉与高温水蒸气反应的化学方程式:_____________________________;
②除去Mg粉中的Al粉的试剂是__________________,反应的离子方程式为:___________________________________;
(3)高铁酸钠(Na2FeO4)具有强氧化性,可对自来水进行消毒、净化。高铁酸钠可用氢氧化铁和次氯酸钠在碱性介质中反应得到,请补充并配平下面离子方程式。
____Fe(OH)3 +____ClO-+____OH- =__FeO42-+___Cl-+_____ _______
(4)在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,氧化剂是___________;
当有2mol H3PO4生成,转移的电子的物质的量为__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸多巴胺可用作选择性血管扩张药,是临床上常有的抗休克药。某研究小组按如下路线合成盐酸多巴胺。
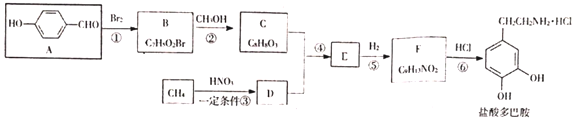
已知:
a.![]()
b.![]()
按要求回答下列问题:
(1)B的结构简式____。
(2)下列有关说法正确的是____。
A.有机物A能与![]() 溶液反应产生无色气体
溶液反应产生无色气体
B.反应①、②、③均为取代反应
C.有机物F既能与HCl反应,也能与NaOH反应
D.盐酸多巴胺的分子式为![]()
(3)盐酸多巴胺在水中的溶解性比多巴胺(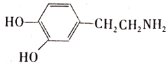 )强的原因是_____。
)强的原因是_____。
(4)写出多巴胺(分子式为![]() )同时符合下列条件的所有同分异构体的结构简式_____。
)同时符合下列条件的所有同分异构体的结构简式_____。
①分子中含有苯环,能使氯化铁溶液显色
②H–NMR谱和IR谱显示分子中有4种化学环境不同的氢原子,没有-N-O-键
(5)设计以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)_____。
的合成路线(用流程图表示,无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
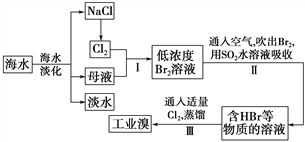
(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
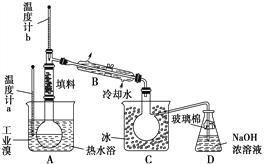
请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用氨气与CuO反应,研究氨气的性质并测其组成,设计了如下实验(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为____________;仪器b中可选择的试剂为(任意填一种)_____________。
(2)实验中,装置C中黑色CuO粉末全部转化为红色固体(已知Cu2O也为红色固体),量气管中有无色无味的气体。实验前称取黑色CuO 80g,实验后得到红色固体质量为68g。则红色固体成分的化学式为_______________。
(3)E装置中浓硫酸的作用是____________________________________。
(4)F中读取气体体积前,应对装置F进行的操作是:___________________,若无此操作,而F中左边液面低于右边液面,会导致读取的气体体积________ (填“偏大”或“偏小”或“无影响”);图中量气管可由________ (请选择字母填空:A.酸式滴定管,B.碱式滴定管)改装而成。
(5)要想测得氨气分子中氮、氢原子个数比,实验中应至少测量或读取哪些数据________。
A.B装置实验前后质量差mg; B.F装置实验前后液面差VL
C.D装置实验前后质量差mg; D.E装置实验前后质量差mg;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若室温下0.1mol·L-1NaX溶液中pH=9,则该溶液中发生水解反应的X-占全部X-的( )
A.0.01%B.0.09%C.1.0%D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关①100mL 0.1 mol/L![]() 、②100mL 0.1 mol/L
、②100mL 0.1 mol/L![]() 两种溶液的叙述不正确的是
两种溶液的叙述不正确的是
A.溶液中水电离出的![]() 个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
个数:②>①B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:![]() D.②溶液中:
D.②溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
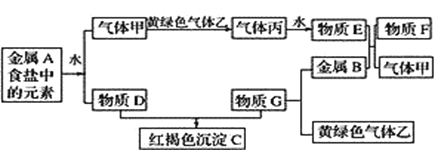
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com