
| A. | 乙酸具有挥发性 | B. | 乙酸是一元酸 | ||
| C. | 乙酸是有机酸而碳酸是无机酸 | D. | 乙酸能与碳酸氢钠反应放出CO2 |
科目:高中化学 来源: 题型:解答题
 钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.
钍试剂滴定法测定烟气中SO3、SO2含量的装置如图所示.| 吸收瓶 | 1 | 2 | 3 |
| 试剂 | 50mL | ||
| 异丙醇 | 50mL 6.8% | ||
| H2O2溶液 | 50mL 6.8% | ||
| H2O2溶液 | |||
| 目的 | 吸收SO3 | 吸收SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g环丙烷和丙烯的混合气体中氢原了数目一定为6NA | |
| B. | 1L 0.1mol/L的NH4NO3溶液中原子数少于0.2NA | |
| C. | 在常温常压下,22.4LHF所含分子数为NA | |
| D. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,将氨水稀释,NH3?H2O 的电离度增大,H2O 的电离度也增大 | |
| B. | 水中加酸加碱都会阻碍水的电离,所以 c(H+)?c(OH-)<10-14 | |
| C. | 水中加酸,阻碍水的电离,所以 c(H+)=c(OH-)<10-7 mol•L-1 | |
| D. | 醋酸溶液加水稀释,溶液中所有微粒的浓度都会降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
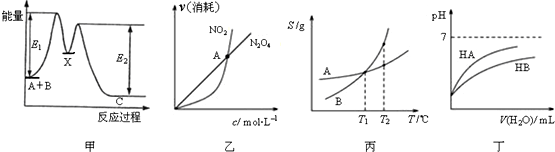
| A. | 由甲可知:加入催化剂可改变反应A+B→C的焓变 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. | 由丁可知:相同温度、相同浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 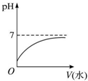 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 溶液中导电粒子的数目增加 | |
| D. | 再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com