
| ||
| 高温 |

| 充电 |
| 放电 |

| 充电 |
| 放电 |


科目:高中化学 来源: 题型:
| A、醋酸水溶液中Kw不变,故醋酸对水的电离无影响 |
| B、该温度下饱和醋酸水溶液的pH=5-lgl.8 |
| C、该温度下浓度均为0.01mol?L-1的CH3COONa溶液和AgNO3,溶液等体积混合(混合溶液体积具有加和性),有CH3COOAg沉淀生成 |
| D、将0.02 mol?L-1的Na2CO3,溶液与CH3COOAg沉淀上清液等体积混合,出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液④显碱性,用离子方程式解释其原因可表示成:CO32-+2H2O?H2CO3+2OH- |
| B、在上述四种溶液中,pH由大到小的顺序为:②④①③ |
| C、将该温度下a mL的溶液②与b mL的溶液③混合,所得混合溶液的pH=7,则a:b=1:2 |
| D、若将溶液④和Al2(SO4)3溶液混合,一定可观察到有白色胶状沉淀和无色气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其分子式为
,其分子式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
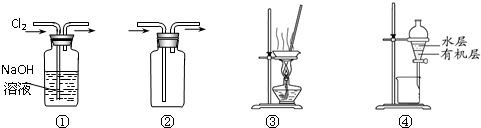
| A、装置①可用于除去Cl2中含有的少量HCl气体 |
| B、按装置②所示的气流方向可用于收集H2、NH3等 |
| C、用图③所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| D、用图④所示装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com