
| A. | 还原剂只有锂 | |
| B. | 标准状况下生成1.12LSO2时,反应转移电子为0.1mol | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | SOCl2中既有离子键,也有共价键 |
分析 4Li+2SOCl2=4LiCl+S+SO2反应中,Li的化合价升高,作还原剂,S元素的化合价降低,作氧化剂,非金属元素之间形成共价键,据此分析.
解答 解:A.Li的化合价升高,作还原剂,故A正确;
B、反应4Li+2SOCl2═4LiCl+S+SO2中,每生成1mol SO2转移4mol电子,则标准状况下生成1.12LSO2时,反应转移电子为0.2mol,故B错误;
C、Li的化合价升高被氧化,LiCl是氧化产物,S的化合价降低被还原,S是还原产物,故C错误;
D、非金属元素之间形成共价键,则SOCl2中只有共价键,故D错误.
故选:A.
点评 本题考查了氧化还原反应、化学键,侧重于基础知识的考查,注意根据氧化还原反应中元素化合价的变化分析,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液与稀H2SO4 | B. | NaOH溶液与醋酸 | ||
| C. | Fe(OH)3溶液与稀H2SO4 | D. | Ba(OH)2溶液与稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
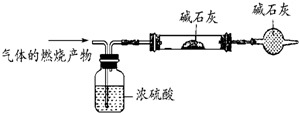
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ•mol-1 | |
| B. | 2SO2(g)+O2(g)?2SO3(g)△H=-98.3 kJ•mol-1 | |
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=+98.3 kJ•mol-1 | |
| D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-196.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
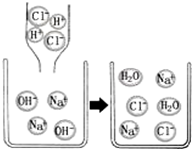
| A. | 反应前后所有元素种类不变 | |
| B. | 恰好反应后溶液的pH大于7 | |
| C. | 反应前的溶液可导电,反应后的溶液不导电 | |
| D. | 中和反应的实质是Na+和Cl-反应生成NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com