
【题目】(1)浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为_________;
(2)等浓度的NaHCO3 、Na2CO3混合溶液中的物料守恒表达式为__________;
(3)硫代硫酸钠(Na2S2O3)溶液与稀硫酸反应的离子方程式为__________;
(4) Fe2(SO4)3溶液显酸性,用离子方程式表示其原因___________;
(5)常温下,NaHCO3溶液中离子浓度由大到小的顺序是___________________________
(6)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合, 当溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________。
【答案】c(CH3COOH)+c(H+)=c(OH-) 2c(Na+)=3c(H2CO3)+ 3c(CO32-)+3c(HCO3-) S2O32-+2 H+=S↓+SO2↑+H2O Fe3++3H2O![]() Fe(OH)3+3H+ c(Na +)>c(HCO3-)> c(OH-) >c(H+)>c(CO32-) 中
Fe(OH)3+3H+ c(Na +)>c(HCO3-)> c(OH-) >c(H+)>c(CO32-) 中 ![]()
【解析】
(1) 质子守恒是指酸失去的质子和碱得到的质子数目相同,浓度为0.1mol/L醋酸钠溶液中质子守恒表达式为c(CH3COOH)+c(H+)=c(OH-);
(2)等浓度的NaHCO3 、Na2CO3混合溶液中Na原子和C原子总数之比为3:2,则物料守恒表达式为2c(Na+)=3c(H2CO3)+ 3c(CO32-)+3c(HCO3-);
(3)Na2S2O3与稀H2SO4溶液作用时产生无色有刺激性气体溶液变得浑浊,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O;
(4) Fe2(SO4)3水解生成氢氧化铁和硫酸,溶液显酸性,用离子方程式表示其原因为Fe3++3H2O ![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(5) NaHCO3在溶液中存在水解和电离,水解程度大于电离程度,溶液显碱性,c(OH-) > c (H+),钠离子不水解,HCO3-电离和水电离都生成H+,所以离子浓度关系为c(Na +)>c (HCO3-)> c(OH-) >c (H2CO3)>c(H+)>c(CO32-);
(6)25℃时,混合溶液呈存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),因为存在c(NH4+)=c(Cl-),所以c(H+)=c(OH-),溶液呈中性,所以c(H+)=c(OH-)=10-7 mol/L,混合后溶液体积增大一倍,所以溶液中c(Cl-)=0.005mol/L,c(NH4+)=c(Cl-)=0.005mol/L,c(NH3H2O)=0.5amol/L-c(NH4+)=0.5amol/L-0.005mol/L,Kb= =
=![]() mol/L=
mol/L=![]() mol/L。
mol/L。


科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上记录如下,卡片上描述合理的是( )

实验记录:
①导线中电流方向:Zn→Cu
②Cu极上有气泡产生,发生还原反应
③锌片变薄
实验结论:
④Zn为正极,Cu为负极
⑤正极反应式:Cu-2e-=Cu2+,发生氧化反应
⑥H+向Cu极移动,SO42-向Zn极移动
A.②③⑥B.④⑤⑥
C.③④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是( )
选项 | 实验目的 | 实验方法 | 相关解释 |
A | 测量氯水的pH |
| pH试纸遇酸变红 |
B | 探究正戊烷(C5H12) 催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
C | 实验温度对平衡移动的影响 |
| 2NO2(g) |
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.2 mol·L-1的氨水中逐滴加入0.2 mol·L-1的盐酸,所得溶液的pH、溶液中NH4+和NH3·H2O的物质的量分数与加入盐酸的体积的关系如图所示。
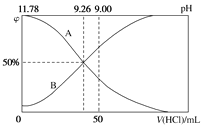
根据图象回答下列问题。
(1)表示NH3·H2O浓度变化的曲线是_____(填“A”或“B”)。
(2)NH3·H2O的电离常数为_____。
(3)当加入盐酸体积为50 mL时,溶液中c(NH4+)-c(NH3·H2O)=___ mol·L-1(用数字表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组用如图所示装置制取氯气,下列说法不正确的是

A.为了防止氯气污染空气,必须进行尾气处理
B.该装置图中存在两处明显错误
C.该实验装置中收集氯气的方法不正确
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以检验是否有氯气逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
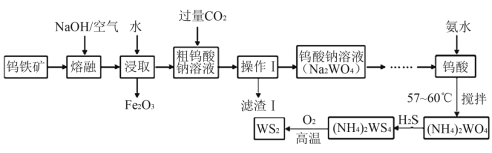
请回答下列问题:
(1)“滤渣Ⅰ”的化学式为__________;
(2)提高“熔融”速率的措施有_____________________(写一条即可);
(3)用离子方程式表示通入过量CO2的主要目的是:________________________;
(4)钨酸与氨水反应时控制温度为58℃,温度不宜太高,其原因是___________。
(5)已知2(NH4)2WS4+3O2![]() 2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
2WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8 mol电子,则生成的气体产物在标准状况下的体积为______L;
(6)常温下,Ksp(CaWO4) =1×10-10。在钨酸钠溶液中滴加澄清石灰水产生钨酸钙沉淀,当溶液中pCa=-1g c(Ca2+)=4,c(WO42-)=_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.在pH=7的溶液中:Fe3+、K+、Cl-、SO42-
B.滴加KSCN溶液显红色的溶液中:NH4+、K+、Cl-、I-
C.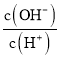 =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D.水电离产生的c(OH-)=10-12 mol/L的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中山大学中山医学院颜光美教授课题组发现一种叫![]() 的天然病毒(属于蛋白质),其能杀死癌细胞而不伤害正常细胞,该病毒含有C、H、O、N、S等元素,其直径大约为
的天然病毒(属于蛋白质),其能杀死癌细胞而不伤害正常细胞,该病毒含有C、H、O、N、S等元素,其直径大约为![]() 。下列说法不正确的是( )。
。下列说法不正确的是( )。
A.![]() 病毒中的C、H、O、N、S原子最有可能以共价键结合
病毒中的C、H、O、N、S原子最有可能以共价键结合
B.![]() 病毒不属于高分子化合物
病毒不属于高分子化合物
C.![]() 病毒溶于水形成的液体具有丁达尔效应
病毒溶于水形成的液体具有丁达尔效应
D.![]() 病毒在生物体内的水解产物可能是氨基酸
病毒在生物体内的水解产物可能是氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有一种燃料电池,所用燃料为H2和空气,电解质为熔融的K2CO3。回答下列问题
①CO![]() 移向____________极。
移向____________极。
②正极反应式为____________________。
③电池中CO![]() 的物质的量将逐渐________________(填增大、减少、不变)。
的物质的量将逐渐________________(填增大、减少、不变)。
(2)用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则

①电源A极是______________极。
②c极上的电极反应式:___________________。
③甲、乙两池共可收集到________mol气体。
④丙装置上某极可析出固体________克,溶液的pH为________________。(常温,不考虑溶液体积变化)
⑤电解n分钟后,硫酸铜正好消耗完,再将e、f电极反接电源,用同样的电流再电解n分钟,则丙溶液中的硫酸铜的物质的量浓度为______________mol/L。(不考虑溶液体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com