
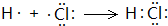 ,
,分析 五种短周期元素A、B、C、D、E的原子序数依次增大.A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为氢元素、B为氮元素,A和C同族,C的原子序数大于氮元素,故C为Na元素,Na+和N3-具有相同的电子层结构,符合题意,B和D 同族,则D为磷元素,C和E形成的原子个数为1:1的化合物,是人们生活的必需品,则E为Cl元素,据此解答.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大.A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为氢元素、B为氮元素,A和C同族,C的原子序数大于氮元素,故C为Na元素,Na+和N3-具有相同的电子层结构,符合题意,B和D 同族,则D为磷元素,C和E形成的原子个数为1:1的化合物,是人们生活的必需品,则E为Cl元素.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故Na元素的原子半径最大,
最高价含氧酸的酸性越强,中心元素的非金属性越强,高氯酸是最强的含氧酸,故Cl非金属性最强,
故答案为:Na;Cl;
(2)由A和D、E所形成的共价型化合物分别为PH3、HCl,非金属性越强氢化物越稳定,故热稳定性最差的是PH3,
故答案为:PH3;
(3)A和E形成的化合物HCl,A和B形成的化合物NH3,二者反应生成NH4Cl,含有离子键、共价键,用电子式表示HCl的形成过程: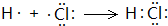 ,
,
故答案为:离子键、共价键;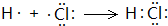 ;
;
(4)P元素的最高价氧化物的水化物的化学式为H3PO4,
故答案为:H3PO4;
(5)氯气与氯化亚铁反应离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:2Fe2++Cl2═2Fe3++2Cl-.
点评 本题考查位置结构性质关系、常用化学用语、元素周期律等,难度中等,推断元素是解题的关键,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | MnO2 | 石蕊溶液 | 石蕊溶液先变红后褪色 | |
| B | 浓硫酸 | 蔗糖 | 品红 | 浓硫酸有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 生成BaSO3白色沉淀 | |
| D | 醋酸 | Na2CO3 | 苯酚钠溶液 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温煅烧石灰石的反应中,反应物总能量高于生成物总能量 | |
| B. | 中和反应中,反应物总能量高于生成物总能量 | |
| C. | 铝粉和盐酸反应时,溶液温度通常会上升 | |
| D. | 氢氧化钡晶体和氯化铵晶体的反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
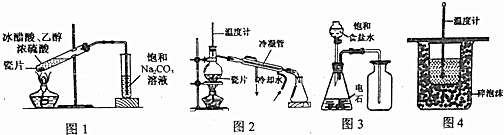
| A. | 用图1装置制取少量乙酸乙酯 | B. | 用图2装置分离苯和溴苯 | ||
| C. | 用图3装置制取并收集乙炔气体 | D. | 用图4装置测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向0.10mol•L-1NaHSO3溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO32-)>c(NH4+) | |
| B. | 0.1mol/L醋酸钠溶液20mL与0.1mol•L-1盐酸10mL混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 已知Kw(HF)>Kw(CH3COOH),pH相等的NaF与CH3COOK两溶液中:c(Na+)-c(F-)>c(K+)-c(CH3COO-) | |
| D. | 0.1mol•L-1醋酸溶液和0.2mol•L-1醋酸钠溶液等体积混合后的溶液中:3c(H+)+2c(CH3COOH)=c(CH3COO-)+3c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
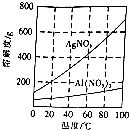 实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:
实验室中利用含银废料(主要含有AgNO3和AgCl)制取硝酸银的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、KOH、RbOH的碱性逐渐增强 | B. | HCl、H2S、PH3的稳定性逐渐减弱 | ||
| C. | Na、K、Rb的原子半径依次增大 | D. | HF、HCl、HBr、HI的稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HS-+H2O?S2-+H3O+ | B. | SO3+H2O?HSO4-+H3O+ | ||
| C. | HCO3-+H2O?CO32-+H3O+ | D. | NH4++2H2O?NH3•H2O+H3O+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com