
【题目】请解答下列与蛋白质有关的题目:
(1)鸡蛋腐烂时,常闻到有臭鸡蛋气味的气体,该气体中主要含有___________________(填化学式),说明蛋白质中含有___________________(填元素名称)元素。
(2)误食重金属盐会中毒,这是因为___________________。
(3)浓硝酸溅在皮肤上,使皮肤呈现___________________色,这是由于浓硝酸和蛋白质发生了___________________反应。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高分子化合物G是一种聚酯材料,其一种合成路线如下:
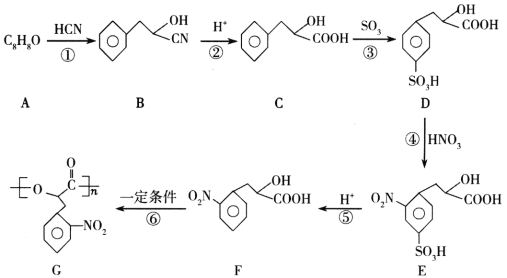
回答下列问题:
(1)A的名称是________,B含有的官能团名称是________。
(2)反应④的反应类型是________。
(3)反应⑥的化学方程式为________。
(4)反应③⑤中引入-SO3H的作用是________。
(5)满足下列条件的C的同分异构体共有________种(不含立体异构)。
①能使FeCl3溶液显紫色;能发生水解反应。②苯环上有两个取代基。
其中核磁共振氢谱显示为5组峰,峰面积之比为3:2:2:2:1,且含有-CH2CH3,该有机物的结构简式是________ (任写一种)。
(6)以CH3CH2CH2OH为原料,设计制备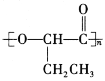 的合成路线:________。
的合成路线:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
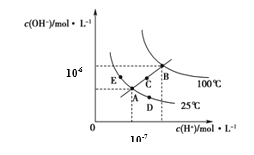
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
C.若从A点到D点,可采用在水中加入少量NaOH的方法
D.若处在B点温度时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇![]() 的氧化锆
的氧化锆![]() 晶体,在熔融状态下能传导
晶体,在熔融状态下能传导![]() 。对该燃料的说法正确的是( )
。对该燃料的说法正确的是( )
A.在熔融电解质中,![]() 由负极移向正极
由负极移向正极
B.电池的总反应是:2C4H10+13O2![]() 8CO2+10H2O
8CO2+10H2O
C.通入空气的一极是正极,电极反应为:![]()
D.通入丁烷的一极是正极,电极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下溶质浓度均为![]() 的几种溶液:①盐酸、②硫酸、③醋酸、④硫酸铵、⑤氨水、⑥氢氧化钠溶液,回答下列问题:
的几种溶液:①盐酸、②硫酸、③醋酸、④硫酸铵、⑤氨水、⑥氢氧化钠溶液,回答下列问题:
(1)在④溶液中,各离子浓度大小顺序为:____________
(2)将③、⑥混合后,若溶液呈现中性,则消耗量溶液的体积为③____________⑥(填“>”、“=”或“<”),溶液中的离子浓度由大到小的顺序为____________
(3)在常温下,将100mL的②与100mL的⑥溶液混合后(假设混合后溶液的体积为混合前溶液的体积之和),溶液的pH=____________(已知![]() )
)
(4)在常温下,六种液体的pH由大到小的顺序是____________
(5)若将③溶液和⑥溶液按体积比2:1混合后溶液呈酸性,则混合后溶液中![]() __________
__________![]() (填“>”、“=”或“<”)
(填“>”、“=”或“<”)
(6)常温下将③溶液加水稀释过程中,下列表达式的数据一定变大的是______
A、![]() B、
B、![]() C、
C、![]() D、
D、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把质量为mg的铜丝灼烧变黑,立即放入下列物质中,能使铜丝变红而且质量仍为mg的是
A.NaOH溶液B.CH3COOHC.稀HNO3D.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Fe和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
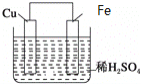
①Fe为正极,Cu为负极;②H+向铁电极移动;③电子是由Fe经外电路流向Cu;④内电路电流由铁电极流向铜电极;⑤若有1mol电子流过导线,则产生的![]() 为
为![]() ;⑥负极的电极反应式为
;⑥负极的电极反应式为![]() 。
。
A.③④B.③⑤C.③④⑤D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。

(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O=H++OH-,下列叙述正确的是( )
A.![]() 表示的粒子不会对水的电离平衡产生影响
表示的粒子不会对水的电离平衡产生影响
B.![]() 表示的物质加入水中,促进水的电离,c(H+)增大
表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时,CH3COO-加入水中,促进水的电离,Kw不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com