
| A、0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA |
| B、常温下,1molO2和O3的混合气体中所含氧原子数为2.5NA |
| C、标准状况下,11.2 L的乙烯中含有的共用电子对数为NA |
| D、13.0g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、 二氧化锰与浓盐酸反应制干燥氯气 |
B、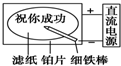 滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用外加保护膜的细铁棒做笔在滤纸上写字显红色字迹 |
C、 石油的分馏 |
D、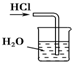 用水吸收氯化氢气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中:c(Ca2+)=c(N03-) |
| B、将0.2mol?L-1 NaA溶液和0.1mol?L-1盐酸等体积混合所得的碱性溶液中(A-为酸根离子):c(Na+)>c(A-)>c(Cl-)>c(OH-) |
| C、0.1mol/L NaAl02溶液中:c(Na+)>c(A102-)>c(OH-)>c(H+) |
| D、浓度均为0.1mo1?L-1的CH3COOH、CH3COONa的混合溶液中:2c(OH-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液的c(H+)为1×10-4 mol?L-1 |
| B、该溶液lmL稀释至100mL后,pH等于6 |
| C、向该溶液中加入等体积、pH为10的氢氧化钠溶液恰好完全中和 |
| D、该溶液中醋酸电离出的c(H+)与水电离出的c(H+)的比值为106 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O.1mol过氧化钠与足量水反应生成的O2分子数为0.1 NA |
| B、1OOmL 2.0mol?L- 1的醋酸溶液中氢离子数为0.2NA |
| C、室温下,30g由CH2O和C2H4O2组成的混合物中含有的碳原子数为NA |
| D、11.6g苯酚钠(C6H5ONa)溶解于水,溶液中C6H5O-离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
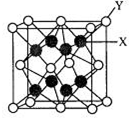 A、B、C、D、E为前四周期元素,原子序数依次增大.基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金.
A、B、C、D、E为前四周期元素,原子序数依次增大.基态A原子的核外电子占据4个原子轨道;B与C同主族,大气平流层中单质B3浓度减少会致人患皮肤癌增加;D是前四周期元素中第一电离能最小的元素;E的合金是当今用量最大的合金.查看答案和解析>>
科目:高中化学 来源: 题型:
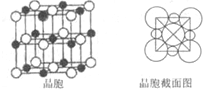 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| KCl | K2SO4 | ZnSO4 |
| 0.3mol | 0.2mol | 0.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com