
【题目】下图是元素周期表的一部分,填写下列空格: 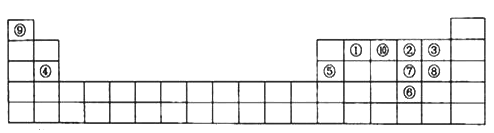
(1)在这10种元素中,非金属性最强的是_________(填化学式,下同);比较③④⑦⑧的简单离子半径由大到小依次为_________________;
(2)元素⑧的气态氢化物的电子式为_____,元素②与⑨形成的18e-化合物的电子式____;
(3)⑧的气态氢化物与⑩的气态氢化物反应的化学反应方程式___________,所得产物中含有的化学键类型有____________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:_____>_______(用化学式表示);
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式_______________;
(6)元素④和③形成的化合物属于________化合物,用电子式表示其形成过程__________。
【答案】 F r(S2-)>r(Cl-)>r(F-)>r(Mg2+) ![]()
![]() NH3+HCl=NH4Cl 共价键和离子键 HCl H2S Al2O3+2OH-+3H2O=2[Al(OH)4]- 离子化合物
NH3+HCl=NH4Cl 共价键和离子键 HCl H2S Al2O3+2OH-+3H2O=2[Al(OH)4]- 离子化合物 ![]()
【解析】根据元素周期表的结构和常见元素在元素周期表中位置知①为碳元素,②为氧元素,③为氟元素,④为镁元素,⑤为铝元素,⑥为硒元素,⑦为硫元素,⑧为氯元素,⑨为氢元素。
(1)同周期从左向右元素的非金属性逐渐增强,同主族由上到下元素的非金属性逐渐减弱,故在这10种元素中,非金属性最强的是F;比较③④⑦⑧的简单离子半径由大到小依次为r(S2-)>r(Cl-)>r(F-)>r(Mg2+)。
(2)HCl的电子式为![]() ,氧元素与氢元素形成的18e-化合物为H2O2,电子式为
,氧元素与氢元素形成的18e-化合物为H2O2,电子式为![]() 。
。
(3)NH3与HCl反应生成NH4Cl,化学方程式为NH3+HCl=NH4Cl ,所得产物中含有的化学键类型有离子键和共价键。
(4)非金属性:Cl>S,气态氢化物的稳定性:HCl>H2S。
(5)氧化铝与氢氧化钠溶液反应生成四羟基合铝酸钠,离子方程式为Al2O3+2OH-+3H2O=2[Al(OH)4]-。
(6)MgF2属于离子化合物,用电子式表示其形成过程为![]() 。
。


科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s) + 2NO(g)![]() CO2(g) + N2(g),平衡时c(NO)随温度T的变化如下图所示,则下列说法正确的是( )
CO2(g) + N2(g),平衡时c(NO)随温度T的变化如下图所示,则下列说法正确的是( )
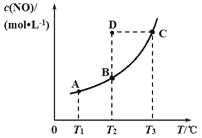
A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 若状态B、C、D的压强分别为pB、pC、pD ,则pC>pD=pB
D. 在T2时,若反应体系处于状态D,则此时v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
A. A的转化率变小 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a > c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
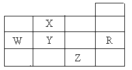
A. 常压下五种元素的单质中,Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物的沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置中能达到实验目的是
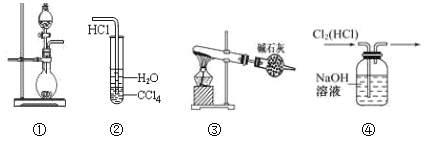
A. 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B. 装置②可用于氯化氢气体溶于水
C. 以NH4Cl为原料,装置③可用于实验室制备少量干燥的NH3
D. 装置④可用于除去Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的纳米基础研究能力已跻身于世界的前列,例如曾作为我国两年前十大科技成果之一就是合成一种一维纳米的材料,化学式为RN.已知该化合物里与氮结合的Rn+核外有28个电子,则R位于元素周期表的( )
A.第三周期ⅤA族
B.第四周期ⅢA族
C.第五周期ⅢA族
D.第四周期ⅤA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)

A. 反应①②③④⑤均属于氧化反应和离子反应
B.反应⑤说明该条件下铝的还原性强于锰
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D.反应①中氧化剂与还原剂的物质的量之比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=1的无色溶液中,下列离子能大量共存的是
A.NH4+、Ba2+、NO3- 、CO32- B.Fe2+、OH-、SO42-、MnO4-
C.Na+、Fe3+、Cl-、AlO2- D.K+、Mg2+、NO3-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com