
| A、以X浓度变化表示的反应速率为0.001mol/(L?S) | ||
B、将容器体积变为20L,Z的平衡浓度变为原来的
| ||
| C、若压强增大1倍,则物质Y的转化率增大1倍 | ||
| D、若升高温度,X的浓度增大,则该反应的△H>0 |
| ||
| 60s |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

 、
、 外,其余的结构简式:
外,其余的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ?m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| A、2 min时,c(SO2)=0.6 mol?L-1 |
| B、用O2表示4 min内的反应速率为0.1 mol?(L?min)-1 |
| C、再向容器中充入1 mol SO3,达到新平衡,n(SO2):n(O2)=2:1 |
| D、4 min后,若升高温度,平衡向逆方向移动,平衡常数K减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某无色溶液中加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- |
| B、向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- |
| C、向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ |
| D、将某溶液进行焰色反应时,火焰呈黄色,则溶液中一定无K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、0.24 mol?L-1 |
| B、0.28 mol?L-1 |
| C、0.32 mol?L-1 |
| D、0.26 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
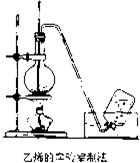 实验室制取乙烯的装置如图所示,请根据图示回答下列问题:
实验室制取乙烯的装置如图所示,请根据图示回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com