
 、NaOH
、NaOH .
. 分析 (1)周期表中位于第2纵行的元素属于第第ⅡA族;
(2)含有8个质子、10中子的原子的化学符号为:18O;
(3)周期表中最活泼的非金属元素氟位于第17纵行;
(4)第四、五周期所含元素是18种;
(5)H2 的电子式H:H;二氧化碳为直线型结构,分子中存在两个碳氧双键;氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合而成.
解答 解:(1)周期表中位于第2纵行的元素属于第第ⅡA族,故答案为:第ⅡA族;
(2)含有8个质子、10中子的原子的化学符号为:18O,故答案为:18O;
(3)周期表中最活泼的非金属元素氟位于第17纵行,故答案为:17;
(4)第四、五周期所含元素是18种,故答案为:四;五;
(5)H2 的电子式H:H;二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为 ;氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合而成,NaOH的电子式:
;氢氧化钠为离子化合物,钠离子与氢氧根离子通过离子键结合而成,NaOH的电子式: ,故答案为:H:H;
,故答案为:H:H; ;
; .
.
点评 本题考查常用化学用语,准确判断物质所含化学键类型、熟练掌握电子式书写方法即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| N2 | H2 | NH3 | |
| 起始物质的量(mol) | 2 | 2 | 0 |
| A. | 平衡时NH3的物质的量:0mol<n(NH3)<$\frac{4}{3}$mol | |
| B. | 平衡时,N2的转化率为$\frac{α}{3}$ | |
| C. | 现将容器体积压缩到原来的一半,再次到达平衡之后,N2的体积分数变小 | |
| D. | 其他条件不变,若起始充入 N2、H2、NH3的物质的分别为:1.5mol、0.5mol、1mol,则到达平衡时,NH3的体积分数为x% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
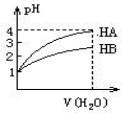 常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )
常温时,pH=1的两种一元酸HA和HB溶液,分别加水稀释1000倍,两溶液的pH与所加水的体积变化如图所示,下列结论中正确的是( )| A. | 在稀释过程中当两者pH分别都是2时,c(HA)>c(HB) | |
| B. | 当稀释100倍时,HB溶液的pH=2 | |
| C. | 在稀释过程中HA与HB溶液中c(OH-)均增大 | |
| D. | 等体积pH=1的HA和HB溶液分别用等物质的量浓度的NaOH溶液中和,消耗碱溶液体积HA等于HB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.
亚硝酸钠(NaNO,)被称为工业盐,在漂白、电镀等方面应用广泛.以木炭、浓硝酸、水和过氧化钠为原料制备亚硝酸钠的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2 的HA溶液与pH=12的MOH溶液等体积混合:c(H+)=c(OH-) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| ① | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| ② | 比较H2CO3、HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液 的pH值,比较pH大小 |
| ③ | 区别植物油和矿物油 | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 |
| ④ | 验证CaCO3的溶解度小于CaSO4 | 将浓Na2CO3溶液加入CaSO4悬浊液中,充分振荡,过滤、洗涤,向所得固体中滴加盐酸,观察是否有气体生成 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗盐提纯时,为了加快过滤速率,可以用玻璃棒进行搅拌 | |
| B. | 分液操作中,将下层液体放入烧杯中,再将上层液体继续放入另一烧杯中 | |
| C. | 测定硫酸铜晶体结晶水含量时,加热后的坩埚须在干燥器中冷却,再称量 | |
| D. | 蒸馏操作中,温度计水银球部位要插入液面下且不接触蒸馏烧瓶瓶壁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com