
| A、HClO |
| B、NO2 |
| C、BeCl2 |
| D、CO2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
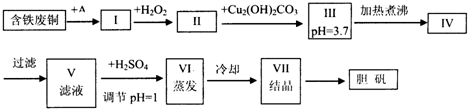
| 物质 | 开始沉淀时的pH值 | 完全沉淀时的pH值 |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化亚铁 | 7.6 | 9.6 |
| 氢氧化铜 | 5.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
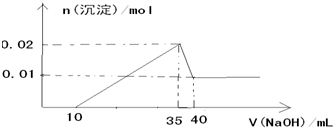
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| V | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫原子的2p轨道和氢原子的1s轨道 |
| B、硫原子的2p轨道和氢原子的2p轨道 |
| C、硫原子的3p轨道和氢原子的1s轨道 |
| D、硫原子的2p轨道和氢原子的3p轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24 g镁的原子最外层电子数为NA |
| B、1 L 0.1 mol?L-1硫酸溶液中H+数为0.1NA |
| C、1 mol甲烷分子所含质子数为10NA |
| D、标准状况下,22.4 L乙醇的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
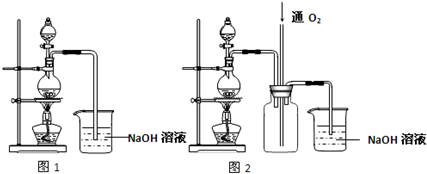
查看答案和解析>>
科目:高中化学 来源: 题型:
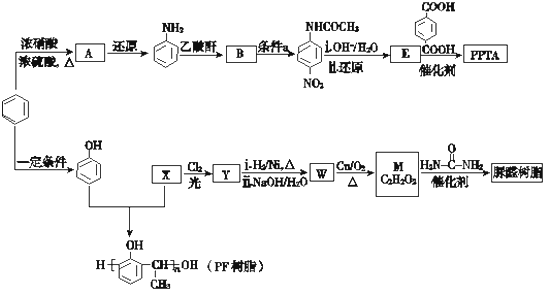
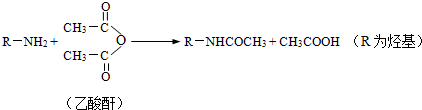
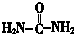 (尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.
(尿素)氮原子上的氢原子可以像苯酚上的氢原子那样与甲醛发生加成反应,并缩聚成高分子.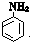 →B的反应类型是
→B的反应类型是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com