
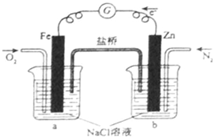
 (2011?海南)根据图,下列判断中正确的是( )
(2011?海南)根据图,下列判断中正确的是( )

 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(2011?浙江)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| 18a |
| b |
| 18a |
| b |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
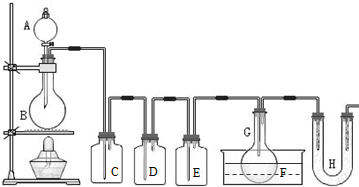 (2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
(2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
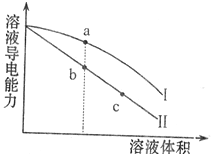 (2011?枣庄模拟)某温度下,向一定物质的量浓度的盐酸和醋酸中分别加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.根据图判断下列说法正确的是( )
(2011?枣庄模拟)某温度下,向一定物质的量浓度的盐酸和醋酸中分别加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示.根据图判断下列说法正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com