
下列有关气体体积的叙述中,正确的是 ( )。
A.在一定的温度和压强下,各种气态物质体积的大小由气体分子的大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由物质的量的多少决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4 L
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源:2014年高考化学苏教版一轮复习3-2从铝土矿到铝合金练习卷(解析版) 题型:选择题
3 g镁铝合金与100 mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g,则原硫酸的物质的量浓度为 ( )。
A.1 mol·L-1 B.1.5 mol·L-1
C.2 mol·L-1 D.2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:填空题
无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法是 。
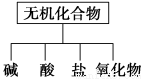
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式: 。
(4)呼吸面具中用⑧作为O2来源的反应原理为: 。
(5)实验室制备⑦常用 和 反应,检验该气体的方法是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-2溶液的配制及误差分析练习卷(解析版) 题型:选择题
V L浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )。
A.通入标准状况下的HCl气体11.2V L
B.加入10 mol·L-1的盐酸0.1V L,再稀释至1.5V L
C.将溶液加热浓缩到0.5V L
D.加入V L 1.5 mol·L-1的盐酸混合均匀
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-1物质的量 气体摩尔体积练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列各项叙述中正确的有( )。
①0.2 mol H2O2完全分解转移的电子数为0.4NA
②25 ℃、101 kPa下,16 g O3和O2混合气体中含有的氧原子数为NA
③将含0.1 mol FeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为0.1NA
④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
A.①②③ B.①②④ C.①②③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-1-2物质的分离和提纯练习卷(解析版) 题型:实验题
实验室可用如图所示的装置进行CO和CO2混合气体的分离和干燥。已知a为止水夹,b为分液漏斗丙的活塞,可供选用的试剂有NaHCO3溶液、NaOH溶液、NaHS溶液、浓硫酸、无水氯化钙、稀硫酸。试填空回答:
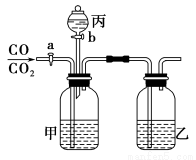
(1)广口瓶甲中应放的试剂为 ,广口瓶乙中应放的试剂为 ,分液漏斗丙中应放的试剂为 。
(2)第一步应先分离出 ,分离时应先关闭 。打开 ,发生反应的离子方程式为 。
(3)第二步分离出 时,先关闭 ,打开 ,发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-1-2物质的分离和提纯练习卷(解析版) 题型:选择题
下列仪器:①普通漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥滴定管;⑦燃烧匙。常用于物质分离的是 ( )。
A.①③④ B.①②⑥ C.①③⑤ D.③④⑦
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(二)(解析版) 题型:选择题
下列实验操作中,主要不是从安全因素考虑的是 ( )。
A.用NH4Cl、Ca(OH)2制备NH3时,可用如图所示装置吸收尾气
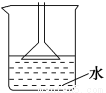
B.制备Fe(OH)2时,吸有NaOH溶液的胶头滴管要插入亚铁盐溶液中再挤出NaOH溶液
C.加热试管中的固体时,试管口应略向下倾斜
D.用氢气还原氧化铜时,先通一会氢气,再加热氧化铜
查看答案和解析>>
科目:高中化学 来源:2014年高考化学指导冲关 第8练金属及其化合物练习卷(解析版) 题型:填空题
由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:

已知物质开始沉淀和沉淀完全时pH如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
沉淀开始时pH | 2.7 | 4.1 | 8.3 |
沉淀完全时pH | 3.7 | 5.4 | 9.8 |
请回答下列问题:
(1)过滤操作用到的玻璃仪器有________。
(2)第①步Al与足量酸反应的离子方程式为___________________________,
得到滤渣1的主要成分为________。
(3)第②步用NaOH调节溶液pH的范围为________。
(4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。
(5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。
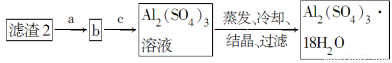
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com