
某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(11分)(1)2~3 min(1分),因该反应是放热反应,此时温度高(2分);4~5 min (2分),因为此时H+ 浓度小(2分)(时间段错误,不得分)
(2)υ(HCl)=0.1 mol/(L·min)(2分,无单位或单位错误扣1分)
(3)A、B (各1分,共2分,多选1个扣1分)
解析试题分析:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、120ml-50ml=70mL、232ml-120ml=112mL、290ml-232ml=68mL、310ml-290ml=20mL,由此可知反应速率最大的时间段为2~3 min。这是由于该反应为放热反应,温度升高,温度对反应速率的影响超过浓度对反应速率的影响,所以反应速率增大。反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,即浓度对反应速率的影响超过温度对反应速率的影响,因此反应速率降低。
(2)在2~3min时间段内,n(H2)=0.112L÷22.4L/mol==0.005mol,根据2HCl~H2可知,消耗盐酸的物质的量为0.01mol,其浓度为0.01mol÷0.1L=0.1mol/L,则υ(HCl)=0.1mol/L÷1min=0.1 mol/(L?min)。
(3)A、加入蒸馏水,H+浓度减小,反应速率减小,且不减少产生氢气的量,故A正确;B、加入Na2SO4溶液,相当于稀释,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;C、加入NaNO3溶液,在酸性条件下NO3-具有强氧化性,与金属反应得不到氢气,而是生成NO气体,影响生成氢气的量,故C错误;D、加入CuSO4溶液,Zn置换出Cu反应速度增大。但由于消耗锌,从而影响生成氢气的量,故D错误;E、加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误,所以答案选AB。
考点:考查外界条件对反应速率的影响、影响反应速率条件的实验探究以及反应速率的计算


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
Ⅰ. 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液后,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向 方向移动,溶液颜色将 。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |



查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g) 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g) △H,2min末达到平衡,生成0.8mol D。
(1)在2min末时,A的平衡浓度为_____________,B的转化率___________,0-2min内D的平均反应速率为_____________。
(2)该反应的平衡常数表达式为:K=_____________。该温度下的化学平衡常数数值为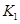 =____________。
=____________。
已知350℃时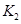 =l,则△H________0(填“>”或“<”)。
=l,则△H________0(填“>”或“<”)。
(3)在300℃时,将该反应容器压缩体积为lL。则A的转化率___________(填“增大”、“减小”或“不变”),原因是__________________。该条件下的平衡常数为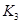 。 则K3________
。 则K3________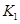 ,(填“<”或“>”或“=”)。原因是_______________________。
,(填“<”或“>”或“=”)。原因是_______________________。
(4)能判断该反应是否达到化学平衡状态的依据是__________________(多选扣分)。
A.容器中压强不变 B.混合气体中c(A)不变
C.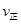 (A)=
(A)=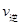 (C) D.混合气体密度不变
(C) D.混合气体密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。 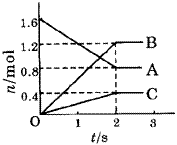
A、B、C三种物质的物质的量随时间变化的关系图
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁及其化合物在生产、生活中应用广泛。
(1)一定条件下,Fe与CO2可发生反应:
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
该反应的平衡常数(K ) 随温度(T ) 升高而增大。
①该反应的平衡常数K=______。(填表达式)
②下列措施中,能使平衡时c(CO)/c(CO2) 增大的是 (填标号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加一些铁粉 |
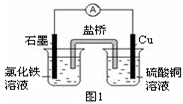
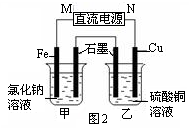
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)向体积为2L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应:
2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y的物质的量浓度变化表示的速率为 。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲v(X)=3.5mol/(L?min);乙v(Y)=2mol/(L?min);丙v(Z)=4.5mol/(L?min);丁v(X)=0.075mol/(L?s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号) 。
(3)若向达到(1)的平衡体系中充入氩气,则平衡向 (填"左"或"右"或"不")移动;若向
达到(1)的平衡体系中移走部分混合气体,则平衡向 (填" 左 " 或 " 右 " 或 " 不")移动。
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,则平衡后X的转化率⑷与⑴的
平衡中的X的转化率相比较 。
| A.无法确定 | B.⑷一定大于⑴ | C.⑷一定等于⑴ | D.⑷一定小于⑴ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: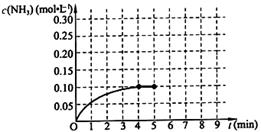
根据图,计算从反应开始到平衡时,平均反应速率v(NH3)= 。
⑵下列描述中能说明上述反应已达平衡的是 。
| A.3v正(H2)=2v逆(NH3) |
| B.容器中气体的平均相对分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用化学反应原理相关知识同答
I.根据下表所示化学反应与数据关系回答下列问题: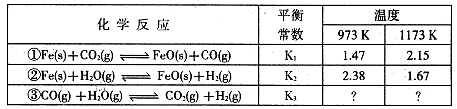
(1)反应①是 (填“吸热"或“放热”)反应。
(2)根据反应①与②可推导出同温下K1、K2与K3之间的关系,则K3= (用K1、K2表示)。
(3)若反应③的逆反应速率与时间的关系如图所示: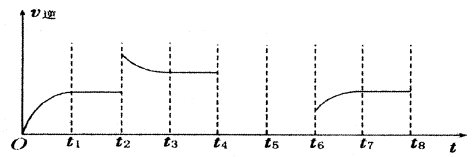
①反应在t1、t3、t7时都达到了平衡,若t2时只改变了一种外界条件j试判断:改变的条件可能是 。
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。
II.请根据醋酸的电离平衡回答下列问题:
(1)常温下,0.1mol/L 的CH3COOH溶液中有l%的CH3COOH分子发生电离,则溶液的pH= 。
(2)将上述溶液加蒸馏水稀释,在稀释过程中,下列各项中增大的是 (填字母编号)。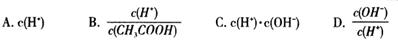
(3)25℃时,CH3COOH的电离平衡常数为1.75×10-5,现将一定量的CH3COOH与NaOH溶液混合,若测得混合液pH=5.6,则混合液中各离子浓度由大到小的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com