
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为: (注明试剂、现象)。
②检验滤液A中是否含有Fe2+的试剂是 ,其实验现象为 。
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、 (填操作名称)、洗涤。
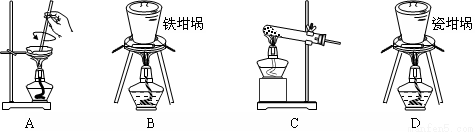
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为 (填代号)。
(1)①取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。(其他合理答案均得分)
②酸性KMnO4 滴入的酸性KMnO4的紫红色褪去(其他合理答案均得分)
③过滤
(2)B
【解析】
试题解析:(1)①滤液B中铁元素的存在形式为Fe3+和Fe2+,所以检验是否还有铁元素也即检验是否还有Fe3+和Fe2+,因此取少量滤液B,加入KSCN溶液,若不变红,再加入氯水,仍然不变红,说明滤液B中不含铁元素。
②滤液A中含有Fe3+和Fe2+,检验Fe2+的存在需选择和Fe2+反应而不和Fe3+反应的试剂且现象明显,例如,酸性KMnO4溶液,溴水等。
③滴加浓盐酸目的是在加热过程中防止氯化铝水解,冷却结晶后得氯化铝的晶体,过滤可得。
(2)蒸发皿、玻璃试管、瓷坩埚中均含有SiO2,易与NaOH反应,所以制备硅酸钠应选择铁坩埚,答案选B。
考点:考查铝、硅化合物在工业生产中的应用以及铁元素的检验


科目:高中化学 来源:2016届江苏省宿迁市高一上学期第二次月考化学试卷(解析版) 题型:选择题
设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,不能达到预期目的的是
A.分别向等质量的白色粉末中加等体积适量的水,比较固体溶解量的多少
B.分别配成溶液,加入Ca(OH)2溶液,比较是否有沉淀生成
C.分别配成溶液,做焰色反应,观察火焰的颜色
D.分别将等量的白色粉末用右下图装置进行实验,比较澄清石灰水是否变浑浊
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南京市高淳区高一上学期期末考试化学试卷(解析版) 题型:填空题
阅读材料,回答下列问题。
材料:近年来,科技人员研究得到一种新型材料——泡沫铝。它是把发泡剂加到熔融铝合金中制成的,其优点是硬度高,密度小(约为0.16~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年可大批量投放市场。
(1)下列关于泡沫铝的说法错误的是 。
A.泡沫铝即是铝单质泡沫
B.泡沫铝是一种合金
C.泡沫铝是一种优质的建筑材料和轻质材料
D.泡沫铝可用于飞机制造
(2)铝制成铝箔作食品包装,是利用它的哪一性质 。
A.金属光泽 B.延展性 C.导电性 D.导热性
(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜遇到强酸或强碱都会溶解,请写出:
①与盐酸反应的离子方程式: ;
②与氢氧化钠溶液反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南京市高淳区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是
A.2NaOH+H2SO4=Na2SO4+2H2O B.Ba(OH)2+2HCl=BaCl2+2H2O
C.KOH+HCl=KCl+H2O D.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
查看答案和解析>>
科目:高中化学 来源:2016届江苏省南京市高淳区高一上学期期末考试化学试卷(解析版) 题型:选择题
不是Fe(OH)3胶体和MgCl2溶液共同具备的性质是
A.都比较稳定,密封放置不产生沉淀 B.都有丁达尔现象
C.加入NaOH溶液都可产生沉淀 D.分散质微粒均可透过滤纸
查看答案和解析>>
科目:高中化学 来源:2016届江苏省东台市高一上学期期末考试化学试卷(解析版) 题型:选择题
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是( )
A.加入KSCN溶液一定不变红色
B.溶液中一定含Fe2+
C.溶液中一定含Cu2+
D.剩余固体中一定含铜
查看答案和解析>>
科目:高中化学 来源:2016届江苏南京市高一上学期期中考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A、标准状况下,11.2L的水中含有0.5个NA水分子
B、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Mg2+的个数为0.5NA
C、1 mol H2和O2的混合气体中含NA个分子
D、11.2L NH3中所含的原子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2016届广东省梅州市高一上学期质检化学试卷(解析版) 题型:计算题
实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
⑴此浓盐酸的物质的量浓度是多少?(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL?(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号): 。
①计算 ②装瓶③用50 mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com